GUIA FOTOGRAFICA – Rafael A. Cruz Soto

Juan Bravo Chacón
RESUMEN. Introducción. La flora y macrofauna del manglar de Jicaral. Métodos. Se hicieron observaciones y recolecta de las especies de flora y macrofauna, cada uno de los ejemplares se identificó, fotografió, posteriormente se elaboró una lista de todas las especies. Resultados. De la flora 8 especies (4 de árboles, 2 de gramíneas, 1 hierba, 1 gramínea). De la fauna 56 especies (11 de moluscos, 9 de crustáceos, 5 de insectos, 6 de peces, 1 anfibio, 8 de reptiles, 11 de aves y 5 de mamíferos). Conclusión. Este estudio pone en evidencia la importancia de los inventarios florísticos, que contribuyen con el aumento del conocimiento de la biodiversidad de los manglares.

Sinónimos: Hilairanthus bicolor (Standl.)
Son árboles que alcanzan un tamaño de 5–13 m de alto. Hojas ovadas, ovado-oblongas, ápice redondeado-obtuso, base obtusa o redondeada y luego abrupta y cortamente decurrente. Inflorescencia en forma de panícula de espigas 2–3-compuestas, flores casi siempre en pares bien separados en el raquis, bráctea floral oblonga, bractéolas suborbiculares 2–2.5 mm de diámetro; cáliz 3.5–4 mm de largo; corola 5.5–7 mm de largo; estambres con anteras a la altura de la boca del tubo, los 2 estambres internos con filamentos gibosos y arqueados, pareciendo más cortos que los 2 exteriores. Fruto elíptico, no oblicuo o apiculado. Se encuentra en las costas del océano Pacífico oriental, desde el sur de México hasta Panamá.

Sinónimos: Avicennia africana P.Beauv., Avicennia elliptica Holm; Avicennia floridana Raf., Avicennia germinans (L.) Stearn; Avicennia germinans var. cumanensis (Kunth) Moldenke; Avicennia germinans var. guayaquilensis (Kunth) Moldenke; Avicennia lamarckiana C.Presl; Avicennia meyeri Miq. ; Avicennia nitida Jacq. ; Avicennia oblongifolia Nutt. ex Chapm.;Avicennia tomentosa Jacq.; Avicennia tomentosa var. campechensis Jacq.; Avicennia tomentosa var. cumanensis Kunth; Avicennia tomentosa var. guayaquilensis Kunth; Avicennia tonduzii Moldenke; Bontia germinans L.; Hilairanthus nitidus (Jacq.) Tiegh.
Hilairanthus tomentusus (Jacq.) Tiegh.
Descripción:
Es un árbol o arbusto que alcanza un tamaño de 3-10 m de alto. A diferencia de otras especies de mangle, esta especie posee un tipo de raíces llamadas neumatóforos que permiten a la planta respirar incluso cuando está sumergida.
Tiene hojas angostas, elíptico-oblongas, con el ápice agudo y base cuneada. Son de color verde oscuro, aunque a menudo aparecen blanquecinas por la sal excretada durante la noche y en días nublados. Inflorescencia en forma de espiga, flores agrupadas en los extremos, bráctea floral ovada, bractéolas lanceoladas, estambres con anteras exertas, filamentos filiformes. Fruto ovado-oblicuo, apiculado, Se reproduce por viviparidad. Sus semillas germinan aún encerradas en el fruto, antes de caer al agua.
La germinación se produce en pleno verano, aunque se pueden ver los frutos llenos de semillas en los árboles durante todo el año. A pesar de crecer en un ambiente marino, la madera seca está sujeta al ataque de barrenadores y termitas marinas. La madera es fuerte, pesada y dura, difícil de trabajar debido a su grano entrelazado y su textura grasosa. Se utiliza para leña y carbón; en carpintería para postes, pilotes, vigas. El tanino de la corteza se ha utilizado para curtir el cuero.

Sinónimos: Rhizophora samoensis (Hochr.) Salvoza (1936); Rhizophora americana Nutt. (1842); Bruguiera decangulata Griff. (1854).
Descripción:
Los árboles de Rhizophora mangle son de 4 a 10 metros de alto, su forma es de árbol o arbusto perennifolio, halófilo, en el tronco se encuentran apoyadas numerosas raíces aéreas simples o dicotómicamente ramificadas con numerosas lenticelas, la corteza es de color olivo pálido con manchas grises, sin embargo, en el interior es de color rojizo, su textura es de lisa a levemente rugosa con apariencia fibrosa. Las hojas son simples, opuestas, pecioladas, de hoja redondeada, elípticas a oblongas, estas se aglomeran en las puntas de las ramas, su color es verde oscuro en el haz y amarillentas en el envés. Las flores son pequeñas, con cuatro sépalos lanceados, gruesos y coriáceos. La flor tiene cuatro pétalos blancos amarillentos. Tiene de dos a cuatro flores por tallo o pedúnculo. Los frutos se presentan en forma de baya de color pardo, coriácea, dura, piriforme, farinosa. El desarrollo de las semillas se lleva a cabo en el interior del fruto por “viviparidad”, los propágulos son frecuentemente curvos, de color verde a pardo en la parte inferior y presentan numerosas lenticelas y por último sus raíces son fúlcreas, ramificadas, curvas y arqueadas. Con el fin de tolerar todas estas condiciones a las cuales se encuentran expuestas, las plantas han desarrollado ciertas estrategias de adaptación fisiológicas y anatómicas como una marcada tolerancia a las altas concentraciones de sal, adaptaciones para ocupar suelos inestables, adaptaciones para intercambiar gases en sustratos anaeróbicos y embriones capaces de flotar que se dispersan transportados por el agua.

Sinónimos: Terminalia erecta (L.) Baill; Conocarpus procumbensis L. Conocarpus seriaeus J. R. Forst ex G. Don; Conocarpus acutifolius Humb & Bonpl.ex Roem. & Schult.
Descripción:
Por lo general una forma densa de arbusto multi-troncal de entre 1 y 4 m de altura, pero puede crecer hasta convertirse en un árbol de hasta 20 m de altura o más, con un tronco de hasta 1 m de diámetro. La corteza es gruesa y tiene amplias placas delgadas, en una escala de color de gris a castaño. Las ramas son frágiles. Las hojas son alternas, simples y oblongas, de 2 a 7 cm de longitud (raramente de 10 cm de largo) y de 1 a 3 cm de ancho, con una disminución en la punta; son de color verde oscuro y brillante en el haz, y de tono pálido, con pelos finos y sedosos por el envés; la base de cada hoja tiene dos glándulas de sal. La madera es parda, muy dura, fuerte y de grano fino, utilizada en algunas regiones para construcción o para hacer carbón. La corteza y hojas tienen gran cantidad de taninos. Medicinalmente se ha empleado como tónico astringente y en casos de orquitis. Árbol pequeño o arbusto, hasta de 10 m de altura. Hojas simples, alternas, de 3 a 10 cm de largo por 1.5 a 3.5 cm de ancho, de lanceoladas a elípticas, con 2 glándulas en la base, ambas características evidentes por el envés. Flores dispuestas en cabezuelas. Frutos drupas aladas de hasta 1.25 cm de diámetro, color pardo púrpura, con todas las partes florales persistentes.

Terminalia catappa o almendro indio, es una especie arbórea de la familia Combretaceae. Se conoce comúnmente también como almendro mexicano, almendro malabar y almendrón. Es una especie originaria de Malasia. El árbol de esta especie mide unos 20 m de alto, se comporta como siempreverde en cultivo, pero es caducifolio en su hábitat silvestre. Posee una copa extendida y un follaje verde intenso muy ornamental. Las flores son blancas o verdosas y están agrupadas en inflorescencias axilares.Las hojas del almendro indio se tornan rojizas antes de caerse. El almendro indio es una especie cuyo fruto es una drupa carnosa con forma ovoide y una semilla con sabor y aroma muy agradable al paladar. El contenido proteico, fibroso y energético del almendro indio permite proponerlo como sustituyente de algunos alimentos de origen animal. Habita en lugares con temperaturas promedio de 25 °C, y precipitación anual entre 2000 y 7000 mm. Es una especie susceptible a las termitas.

Sinonimos: Cyperus callophorus G.Mey; Cyperus coriaceus (G.Mey.) Schrad. ex Nees; Cyperus coriaceus Schrader; Cyperus dissolutus Kunth; Cyperus glandulosus (Bojer) Rolfe; Cyperus glaucoviridis Boeckeler; Cyperus ligularis var. spicatocapitatus (Steud.) Kük.; Cyperus punctatifolius Steud.; Cyperus rionensis Boeckeler;Cyperus sintenisii Boeckeler; Cyperus spicatocapitatus Steud.; Cyperus thyrsiflorus Boeckeler; Cyperus trigonus Boeckeler; Cyperus ubertus Willd. ex Link; Cyperus vulnerans Salzm. ex Schltdl.; Mariscus coriaceus G.Meyer; Mariscus dissolutus (Kunth) T. Koyama; Mariscus glandulosus Bojer; Mariscus ligularis (L.) Urb.; Mariscus rufus Kunth;
Descripción:
Planta perenne, cespitosa, robusta, con rizomas oblicuos, de 10–40 mm de grueso; culmos triquetros, papilosos, glaucos cuando frescos. Hojas con láminas en forma de V, los márgenes y nervios medios ásperamente escabrosos. Brácteas de la inflorescencia, café-rojizas, raquilla alada, decidua; escamas, persistentes. Fruto trígono, obovoide a ampliamente elipsoide, apiculado, punteado, café, ligeramente estipitado. Distribución: Es una especie común que se encuentra en playas, pantanos salobres, manglares, áreas alteradas, zanjas, a lo largo de las costas atlántica y pacífica.

Sinónimos: Panicum paniculatum (L.) Kuntze; Paspalum affine Bello; Paspalum compressicaule Raddi; Paspalum cordovense E.Fourn.; Paspalum galmarra F.M.Bailey; Paspalum guineense Steud.; Paspalum hemisphericum Poir.; Paspalum multispica Steud.; Paspalum paniculatum var. rigidum Schltdl. ex E.Fourn.; Paspalum polystachyum Salzm. ex Steud.; Paspalum strictum Pers.; Paspalum supinum Rupr. ex Galeott.
Descripción:
Es una perenne , cespitose planta herbácea con erecto tallos ( cañas ) que pueden alcanzar los 30 cm a 2 m de largo. Las hojas, con una hoja afilada de 9 a 50 cm de largo y de 6 a 25 mm de ancho, tienen una lígula membranosa no ciliada de 2 a 3 mm de largo. La inflorescencia es una panícula compuesta de racimos en forma de espiga, de 4 a 12 cm de largo, cuyo número varía de 7 a 60, dispuestos unilateralmente a lo largo de un eje central. Las espiguillas fértiles, orbiculares, comprimidos dorsalmente, de 1.3 a 1.4 mm de largo, incluyen un remate basal estéril y un flósculo fértil, sin extensión del raquillón. Se desprenden enteros al desarticularse en la madurez. Tienen una sola gluma, estando la gluma inferior ausente o muy reducida. La segunda gluma, orbicular, con ápice obtuso, membranosa, de color café oscuro, es tan larga como la espiguilla. Los flósculos estériles muestran una lemma membranosa elíptica similar a la segunda gluma. La lemma de los flósculos fértiles, de 1 a 1.2 mm de largo, es orbicular hemisférica, gibosa, estriada en la superficie.

Son hierbas anuales, que alcanzan un tamaño de 0.3–0.6 m de alto, erectas; ramas estriadas, tomentosas con tricomas en forma de T o aplicado-pubescentes cuando jóvenes, glabrescentes. Hojas caulinares espatuladas, obovadas a ampliamente ovadas, ápice agudo, obtuso o subagudo, base cuneada a atenuada, márgenes gruesamente dentados a remotamente dentados o sinuados, escasamente hirsutas con tricomas en forma de T en el haz, punteado-glandulares e hirsutas en el envés; pecíolos angostamente alados.
Sinónimos: Blumea chinensis (L.) DC.; Conyza chinensis L.; Conyza cinerea L.; Serratula cinerea (L.) Roxb.; Vernonia cinerea (L.) Less.; Blumea esquirolii H.Lév. & Vaniot, Cacalia arguta Kuntze; Cacalia cinerea (L.) Kuntze; Cacalia erigerodes Kuntze; Cacalia exilis Kuntze; Cacalia kroneana Kuntze; Cacalia linifolia DC.; Cacalia rotundifolia Willd.; Cacalia vialis Kuntze; Calea cordata Lour.; Cineraria glaberrima Spreng. ex DC.; Conyza heterophylla Lam.; Conyza incana DC.; Conyza prolifera Lam.; Crassocephalum flatmense Hochst. & Steud. ex DC.; Cyanopis decurrens Zoll. & Mor.; Eupatorium arboreum Reinw. ex de Vriese; Eupatorium myosotifolium Jacq.; upatorium sinuatum Lour.; Pteronia tomentosa Lour.; Seneciodes cinerea (L.); Seneciodes cinereum (L.) Kuntze ex Kuntze; Vernonia abbreviata DC.; Vernonia arguta Baker; Vernonia betonicaefolia Baker; Vernonia exilis Miq.; Vernonia fasciculata Blume; Vernonia kroneana Miq.; Vernonia vialis DC.

Sinónimo: Catenella caespitosa (Withering) Irvine in Parke & Dixon, 1976
Alga roja de unos 20 mm de altura. Talo formado por una parte reptante a modo de estolón, cilíndrico, fino, con ramificación bastante irregular. Éste origina ramas aplanadas o subcilíndricas, con constricciones a intervalos irregulares que originan segmentos, generalmente de unos 2 mm de longitud. Color rojo pardusco. El gametofito y el tetrasporofito tienen la misma morfología. El gametófito, o gametofito, es un organismo haploide multicelular originado de una espora diploide o esporófito. Corresponde a la fase haploide de un vegetal, destinada a producir gametos, y a la fase sexual en una de las dos fases alternas en el ciclo de vida de las plantas terrestres y algas marinas.
GUIA FOTOGRAFICA DE LA MACROFAUNA DEL MANGLAR DE JICARAL
Introducción
Los manglares se definen por la presencia de árboles que se encuentran principalmente en la zona intermareal, entre la tierra y el mar, en los trópicos. Esta zona se caracteriza por factores ambientales muy variables, como la temperatura, la sedimentación y las corrientes. El agua, los árboles y el dosel proporcionan un hábitat importante para una amplia gama de especies. Estos incluyen aves, insectos, mamíferos y reptiles. Debajo del agua, las raíces de los manglares están cubiertas de epibiontes como tunicados, esponjas, algas y moluscos. El sustrato blando en los manglares forma hábitat para varias especies de infauna y epifauna, mientras que el espacio entre las raíces proporciona refugio y alimento para la fauna móvil como langostinos, cangrejos y peces. La basura orgánica del manglar se transforma en detritus, que en parte apoya la red alimentaria de los manglares. Plancton, algas epífitas y microphytobenthos también forman una base importante para la red alimentaria de los manglares. Debido a la alta abundancia de alimentos y refugio, y la baja presión de depredación, los manglares forman un hábitat ideal para una variedad de especies animales, durante parte o la totalidad de sus ciclos de vida. Como tal, los manglares pueden funcionar como hábitats de vivero para (comercialmente importante) especies de cangrejos, langostinos y peces, y apoyar las poblaciones de peces y pesquerías en alta mar.

Sinonimos: Arca grandis Broderip & G.B.Sowerby I, 1829; Arca quadrilatera Sowerby, 1833; Arca larkinii Nelson, 1870; Scapharca grandis Maury, 1922

Las conchas son grandes y ovaladas, relativamente gruesas. Las valvas muestran entre 33 y 37 costillas, con los márgenes dorsales angulados. Su color es blanco, cubierto por un periostraco piloso que va desde castaño oscuro hasta negro. Posee ambos anchos y prominentes. Los nódulos o tubérculos de las costillas son la razón del nombre de la especie. Su área cardinal es angosta. además, existen tipos y tipos de conchas y se las encuentra en distintos lugares de las costas, desde México hasta Perú.

Sinónimos: Modiolus bicolor Lamarck, 1819; Mytella bicolor. Bruguière, 1792; Modiola bicolor Lamarck, 1819; Modiolus brasiliensis Hanley, 1843; Mytella brasiliensis Gray, 1825; Modiola brasiliensis Gray, 1825; Modiola brasiliensis mutabilis Carpenter, 1857; Mytella guyanaensis Lamarck, 1819; Modiola semifusca Sowerby, 1825; Modiolus sinuosa King, 1832; Modiola sinuosa King & Broderip, 1832; Modiola subfuscata Clessin, 1887; Mytilus umbonata Anton, 1838; Mytella umbonata Anton, 1838.
Descripción:
Su concha es oblonga, relativamente delgada. El umbo se encuentra cera del borde anterior de la concha. El periostraco es delgado, su color varia de un tono verdoso hasta casi negro y hace una separación en dos zonas; sobre la parte posterior la coloración es opaca o verdoso oscuro, generalmente con finas líneas en zigzag; en la parte ventral el color es típicamente un café vidrioso. Una línea de color café marca con mayor intensidad las dos zonas. El interior de la concha es blanquecino iridiscente, con manchas violetas sobre las huellas musculares.

Descripción:
Concha alargada, casi rectangular. Es de color blanco cubierta por un periostraco oliva oscuro y casi siempre gastado en los umbos. Charnela con dos dientes cardinales pequeños. El seno paleal es delgado sin llegar a la mitad de la concha.

Sinónimos: Protothaca asperrima (G. B. Sowerby I, 1835); Venus asperrima G. B. Sowerby I, 1835
Descripción:
Su concha es grisácea-amarillenta a blancuzca, con una gran variedad de manchas café. Sus valvas poseen una gran cantidad de costillas, radios y líneas transversales que le dan un aspecto áspero y reticulado. Concha subcircular o subovalada, moderadamente convexa.

Sinónimos: Littorina varia Sowerby, 1832; Littorina variegata Souleyet, 1852; Littorina costulata Tryon, 1887.
Descripción:
Concha de forma romboidal, de consistencia gruesa; su color es pardo-grisaceo, moteada con puntos café. Con muchas costillas radiales cubiertas con pequeños nódulos, abertura de color blanco.

Sinónimos: Cerithidea montagnei (d’Orbigny, 1841); Cerithium montagnei d’Orbigny, 1841
Descripción:
Tiene la concha de forma Sowerby conoca alargada. Muestra cerca de nueve redodeadas de coloración marron-grisacea con bandas de color gris-anaranjado. Presenta costllas axiales que le dan un aspecto escaleriforme, vueltas no presentan varices. Su abertura es grande y redondeada. Los adultos presentan lábio externo doblado hacia afuera

Sinónimos: Littorina zebra Donovan, 1825; Littorina pulchra Sowerby, 1832.
Descripción:
Concha sólida, de espira corta y puntiaguda. De color naranja con bandas oblicuas de color café. Labio interno marrón. El labio externo presenta 5 o 6 puntos de color café que corresponden a las bandas de la superficie que terminan en la abertura.

Sinónimos: Littorina fasciata Gray, 1839
Descripción:
Su concha es de forma oblonga, gruesa de color café amarillento con bandas oblicuas y axiales. El borde externo es afilado, de color café oscuro. Posee una abertura ovalada, con el borde externo marcado con aproximadamente 15 marcas de color café Labio interno blanco con una mancha café.

Presenta una concha de forma ovoide de color café rojizo oscuro. Presenta tres bandas blanquecinas en la superficie y una mancha de matiz pardo sobre la columela. Abertura alargada, labio externo afilado, labio interno con algunos dentículos.
Sinónimo: Auricula caroliana Lesson, 1842

Concha elongada con la longitud de la aberura igual a la de la espira. Concha de color blanquesino en formas jovenes y crema en los adultos, cubierta con un periostraco cafe verdoso. La aberura blanca con dos o tres pliegues columelares. El labio externo es liso, en adultos muestra un reborde.
LOS CRUSTACEOS

Sinónimos: Chthamalus rhizophorae De Oliveira, 1940; Euraphia rhizophorae (de Oliveira, 1940)
Generalmente unidos a raíces de Rhizophora. Se distribuyen desde Costa Rica hasta Brasil y las Antillas. Concha cónica baja, ceja oscura. Escudo alto, cresta articular alrededor de 2/3 de longitud del margen tergal, surco articular alargado, músculo aductor profundamente alargado. Tergum alto con un surco articular abierto.
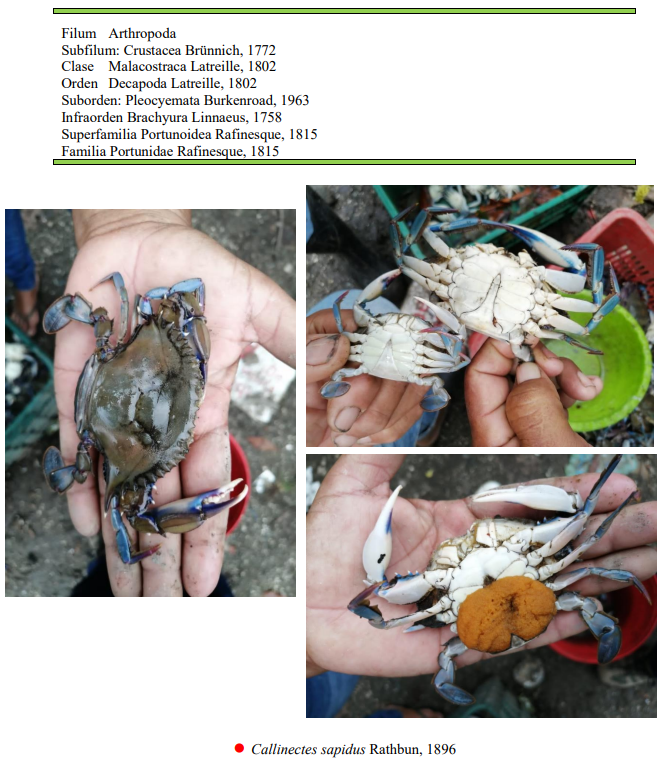
El caparazón de Callinectes sapidus puede crecer hasta un ancho de 23 cm. Se puede distinguir de otras especies relacionadas que habitan en la misma área por el número de dientes frontales en su caparazón; C. sapidus tiene cuatro, mientras que C. ornatus tiene seis. Los machos y las hembras de C. sapidus se pueden distinguir por el dimorfismo sexual en la forma del abdomen es largo y delgado (estrecho) en los machos, pero ancho y redondeado en las hembras maduras. Los cambios del abdomen de las hembras se ven a medida que estas maduran: en las hembras inmaduras, el abdomen tiene forma triangular, mientras que en las maduras es redondo. La tonalidad azul se deriva de una serie de pigmentos en el caparazón, incluyendo la alfa-crustacianina, que interactúa con un pigmento rojo, la astaxantina, para formar una coloración azul verdosa. Los depredadores naturales de C. sapidus incluyen anguilas, rayas, truchas, algunos tiburones rastreros, rayas nariz de vaca y los seres humanos. La jaiba azul es omnívora, ya que come plantas y animales. Normalmente consume bivalvos de concha fina, anélidos, pequeños peces, plantas, y casi cualquier otro elemento que pueda encontrar, incluyendo carroña.

Sinónimos: Callinectes dubia Kingsley, 1879; Callinectes nitidus A. Milne-Edwards, 1879; Callinectes pleuriticus Ordway, 1863
Descripción:
Se distinguen por presentar un caparazón ancho, aplanado dorsalmente, con nueve dientes sobre el margen anterolateral, el último diente más largo que los demás, propodio y dáctilo del quinto par de pereiópodo típicamente aplanados y generalmente ensanchados para facilitar la natación. Se presentan tanto en aguas salobres como marinas.


Tiene una concha de color azul violáceo, patas rojas y una garra principal blanca. Cardisoma crassum vive comúnmente entre las raíces de los árboles de mangle , donde construye su madriguera. También se encuentra ocasionalmente en la parte más seca de los bancos.
Sinónimo: Cardisoma latimanus Lockington, 1877

Sinónimo: Goniopsis pulcher Lockington, 1876

El cangrejo de mangle es una especie pequeña con machos que miden en promedio unos 2 cm (0,8 pulgadas) de largo y las hembras un poco menos. Los grandes ojos están muy separados y el caparazón es más ancho en la parte delantera que en la trasera. Es un color marrón moteado y oliva que ayuda al cangrejo a mezclarse con su entorno. Las patas son marrones o moteadas y cerca de las puntas hay mechones de pelos negros. Estos son puntiagudos, lo que ayuda al cangrejo a trepar entre el follaje de los manglares.

Sinónimos: Goniograpsus innotatus Dana, 1851; Grapsus declivifrons Heller, 1862; Metopograpsus dubius de Saussure, 1858; Metopograpsus miniatus de Saussure, 1857; Pachygrapsus advena Catta, 1876; Pachygrapsus intermedius Heller, 1862
LOS INSECTOS

Los nidos de N. corniger son de color marrón oscuro en la superficie y tienen pequeñas protuberancias sobre su exterior. Cuando son pequeños (menos de 20 cm de diámetro) tienden a ser esféricos, pero a medida que crecen se vuelven más elípticos. También puede haber lóbulos localizados en la superficie del nido. La reina vive en una cámara ubicada en el centro del nido, (a menudo cerca del tronco o rama del árbol al que está unido el nido), que tiene hasta 8 cm de ancho y 1 cm de alto y fuertemente reforzada. El grosor de las paredes en el nido disminuye lejos de la reina y hacia el exterior, aunque si el nido es atacado por depredadores, las paredes se reforzarán. Los individuos fértiles tienen alas negras, cuerpos oscuros y ocelos que se encuentran relativamente lejos de los ojos.
Las colonias de termitas son ejemplos de insectos eusociales. Los insectos eusociales son animales que desarrollan grandes sociedades cooperativas multigeneracionales que se ayudan mutuamente en la crianza de los jóvenes, a menudo a costa de la vida o la capacidad reproductiva de un individuo. Tal altruismo se explica en que los insectos eusociales se benefician de renunciar a la capacidad reproductiva de muchos individuos para mejorar la aptitud general de la descendencia estrechamente relacionada. Hay tres castas principales: alados reproductivos, trabajadores y soldados.

Sinónimo: Papilio stelenes Linnaeus, 1758
La camuflada verde tiene grandes alas que son de color negro y brillante de color verde o amarillo-verde en el haz de luz y de color marrón y verde oliva en la parte inferior. El nombre malaquita viene del mineral malaquita, que es similar en color al verde brillante en las alas de la mariposa. Por lo general, la extensión de alas es de entre 8,5 y 10 cm (3,3 y 3,9 pulgadas). La camuflada verde se encuentra en toda América Central y el norte de América del Sur, donde es una de las especies más comunes de mariposa. Su distribución se extiende por el norte hasta el sur de Texas y la punta de la Florida, a Cuba. Los adultos se alimentan de néctar de las flores, frutos podridos, animales muertos, y el estiércol de murciélagos. Las hembras ponen los huevos en las hojas nuevas de plantas de la familia Acanthaceae.

Caligo memnon es una mariposa de la familia Nymphalidae. Las especies se pueden encontrar en las selvas tropicales y bosques secundarios de México hasta la selva tropical de la Amazonia. La envergadura es por lo general de 115 a 130 mm, pero puede llegar a 150 mm. Las larvas se alimentan especies de Musa y Heliconia y puede ser una plaga para el cultivo de plátano. Los adultos se alimentan de los jugos de fruta podrida. Son características de esta especie dentro de su género las manchas claras de las alas anteriores, de color anaranjado, má o menos extensas según las subespecies, y que se complementan con zonas azules y los bordes negros. Por la cara inferior presenta los grandes ocelos que conforman los ojos de búho, con otros ocelos grandes en ambas alas y diversas manchas y líneas que componen un intrincado dibujo. Las orugas, que alcanzan los 10 centímetros de tamaño, se alimentan de plataneros y bananos (Musssa spp.), de otras plantas de la misma familia (Musaceae) y de heliconias. Los adultos, por su parte, chupan los jugos de frutos muy maduros, como los mismos plátanos y bananos, la guanabana (Annona muricata) o el mango (Mangifera indica). Vuelan en las horas crepusculares y nocturnas en gran parte de Sudamérica.

Sinónimos: Ageronia februa Hübner, [1823]; Ageronia atinia Fruhstorfer, 1914; Ageronia februa sabatia Fruhstorfer, 1916; Ageronia februa sellasia Fruhstorfer, 1916; Ageronia ferox maina Martin, [1923]; Nymphalis ferentina Godart, [1824]; Ageronia gudula Fruhstorfer, 1914; Ageronia februa icilia Fruhstorfer, 1916; Ageronia februa f. sodalia Fruhstorfer, 1916; Ageronia februa hierone Fruhstorfer, 1916; Ageronia februa fundania Fruhstorfer, 1916
Los individuos de esta especie pueden distinguirse fácilmente de las otras especies similares del género Hamadryas por tener el lado dorsal gris manchado, además el ocelo más distal presenta una marca con forma de medialuna y de color rojo. Ventralmente, el ala posterior presenta dos líneas irregulares de color pardo, una a cada lado de la línea de los ocelos. Los sexos son monomórficos. El huevecillo es de color blanco y es colocado de forma individual en la planta hospedera. La larva en su primer estadio posee una cápsula cefálica negro brillante, el cuerpo es verde y escasamente cubierto con pelos, con un tamaño cercano a 2.8 milímetros al momento de nacer y alcanza una longitud de 4 milímetros hasta el momento de realizar su primera muda. En el segundo estadio, la larva es pardusca, con la cápsula cefálica negra y aparentemente se empieza a evidenciar el crecimiento de scoli o espinas en el cuerpo y el tórax. Al momento de la segunda muda, la larva alcanza un tamaño aproximado de 8 milímetros. En el tercer estadio, los scoli o espinas empiezan a ser más aparentes en todo el cuerpo de la larva y este patrón se mantendrá durante todos los estadios subsecuentes. Al final del cuarto estadio, la larva tiene aproximadamente 26 milímetros de largo y 3 milímetros de ancho en la región media del tórax. Al finalizar el quinto estadio, la larva alcanza una longitud de 33 milímetros y 3.5 milímetros de ancho en la región del tórax. Los adultos no visitan las flores sino que se alimentan de frutas en descomposición, carroña, excremento y barro. Son bastante crípticas (camufladas) cuando se posan en los troncos de árboles con la cabeza hacia abajo y con las alas extendidas contra el sustrato. Desde estos troncos vuelan para perseguir a otros insectos. Producen un sonido en forma de chasquido mientras vuelan, lo que les da su nombre común de «sonadoras». Entre de sus plantas hospederas se encuentran varias especies de Euphorbiaceae como Dalechampia scandens, Dalechampia heteromorpha, Dalechampia tiliafolia, entre otras especies del género. Esta especie se distribuye desde por todo el país en ambas vertientes, desde el nivel del mar hasta 1500 metros de altitud. La especie se distribuye en el continente desde el sur de Estados Unidos hasta Brasil

Las avispas P. occidentalis se distinguen por sus colores negro y amarillo. El color de base es el negro y tienen unas pocas franjas amarillas en el abdomen. Las alas son delgadas y el tórax está unido al abdomen por un pecíolo largo y fino. Las obreras tienen un peso seco promedio de 3,80 mg a 6,71 mg. La longitud del margen costal de las alas es de 3,6 mm a 4,7 mm. La avispa reina se diferencia de las obreras porque tienen ovarios más grandes. Se encuentra desde México hasta Argentina.3 Esta especie de avispa es común en Costa Rica y Brasil. Vive en regiones neotrópicas que constan de selvas tropicales con gran diferencia estacional húmeda-seca. Así disponen de recursos adecuados para construir los nidos y cazar sus presas en la estación húmeda y sobrevivir con estos recursos en la estación seca. El medio ambiente neotrópico es ventajoso para las colonias que forman enjambres. Habitualmente se asientan donde hay grandes fuentes de hidratos de carbono disponibles.
ANFIBIOS y REPTILES

Sinonimos:
Rana marina Linnaeus, 1758; Bufo brasiliensis Laurenti, 1768; Rana gigas Walbaum, 1784; Rana humeris-armata Lacépède, 1788; Bufo marinus Schneider, 1799; Bufo sonnini, Manoncourt & Latreille, 1801; Rana brasiliana Shaw, 1802; Bufo horridus Daudin, 1802; Bufo humeralis Daudin, 1803; Bombinator maculatus Merrem, 1820; Rana maxima Merrem, 1820; Bombinator horridus Merrem, 1820; Bufo maculiventris Spix, 1824; Bufo lazarus Spix, 1824; Bufo albicans Spix, 1824; Bufo horribilis Wiegmann, 1833; Docidophryne agua Fitzinger, 1843; Docidophryne lazarus Fitzinger, 1861; Phrynoidis agua Cope, 1862; Bufo marinus var. horribilis Peters, 1873;
Bufo marinus var. fluminensis Jiménez de la Espada, 1875; Bufo marinus var. napensis Jiménez de la Espada, 1875; Bufo pithecodactylus Werner, 1899; Bufo marinus marinus Schmidt, 1932; Bufo angustipes Taylor & Smith, 1945; Bufo marinus horribilis Lynch & Fugler, 1965; Chaunus marinus Frost, Grant, Faivovich, Bain, Haas, Haddad, de Sá, Channing, Wilkinson, Donnellan, Raxworthy, Campbell, Blotto, Moler, Drewes, Nussbaum, Lynch, Green, & Wheeler, 2006; Rhinella marinus Pramuk, Robertson, Sites, & Noonan, 20082
Este anfibio tiene grandes glándulas venenosas; los adultos y renacuajos al ser ingeridos son altamente tóxicos para la mayoría de los animales. Es grande y terrestre, Piel seca y verrugosa. Tiene distintas protuberancias que comienzan encima de los ojos y terminan en el hocico. Puede ser gris, marrón, rojo-marrón u oliva. Con gran glándula parotoide detrás de cada ojo. Vientre color crema y a veces manchas en sombras de negro o marrón. Pupilas horizontales con iris dorado. Es nativo de América, desde el valle del Río Bravo en el norte de México hasta el Amazonas central y sudeste de Perú.

Sinónimo:
Hyla rosembergi Boulenger, 1898
Es una especie de anfibios de la familia Hylidae. Habita en las laderas del Pacífico de Costa Rica, Panamá, Colombia y norte de Ecuador.2Sus hábitats naturales incluyen bosques tropicales o subtropicales secos y a baja altitud, ríos, zonas húmedas de arbustos, pastos, jardines rurales y zonas previamente boscosas ahora muy degradadas.

Todos los cocodrilos tienen el cuarto diente de la mandíbula inferior hipertrofiado e incrustado en una cavidad lateral en el exterior de la boca. Este diente está expuesto incluso cuando la boca está cerrada, mientras que en los caimanes está oculto dentro de la boca.
Los dientes superiores de los cocodrilos están alineados con los inferiores, Además, los cocodrilos viven en agua dulce y/o salada, mientras que los caimanes sólo en agua dulce. mientras que los cocodrilos tienen una cabeza más afilada.
Mientras que los cocodrilos tienen una cabeza más afilada. Además, los cocodrilos tienen los llamados poros glandulares en las escamas del vientre. No se conoce la función exacta de estos poros, pero se especula que pueden servir para el intercambio de calor y agua con el entorno.

Los caimanes tienen un hocico ancho y redondeado. No tienen los poros glandulares en las escamas del vientre. La cabeza es ancha. Los dientes superiores no están alineados con los inferiores.

Sinónimos:
Iguana Similis Gray, 1831; Ctenosaura completa (Bocourt, 1874); Ctenosaura similis similis (Gray, 1831)
Ha sido reconocida como el lagarto más rápido de la Tierra (hasta 34,6 km/h) por El Libro Guinness de los récords mundiales.2 Los machos pueden alcanzar 1.3 m de longitud y las hembras 0,8-1 m.2 La cabeza es medianamente distintiva del cuerpo. Sus extremidades son robustas y musculosas. La cola presenta anillos de escamas espinosas muy alargadas. 4 Esta iguana tiene una longitud hocico-cloaca de 27.5 cm a 35 cm. Tienen una cresta de largas espinas que se extiende por el centro de la espalda. La coloración varía mucho entre los individuos de la misma población, los adultos suelen tener un color gris blanquecino o tostado con una serie de 4 a 12 bandas dorsales bien definidas de color oscuro que se extienden casi hasta las escamas ventrales. Los machos desarrollan un color naranjado con reflejos de color azul y melocotón en la mandíbula alrededor de la cabeza y la garganta, todo esto durante la temporada de reproducción.25 Son lagartos diurnos y de rápido movimiento, empleando su velocidad para escapar de depredadores, pero pueden azotar sus colas y morder si son molestados o acorralados.2 Los garrobos (Ctenosaura) aunque están relacionadas con las iguanas (iguana), se diferencian de estas debido a la ausencia de una gran escama al costado de la cabeza.

Mide hasta 2 m de longitud de cabeza a cola. Los machos alcanzan entre 30 y 40 cm de longitud hocico-cloaca, las hembras cerca de 10 cm; cola extremadamente larga y algo aplanada lateralmente. Llega a pesar más de 15 kg. Cabeza angosta, hocico redondeado en vista dorsal y truncado en vista lateral; ojos grandes con pupilas verticalmente elípticas; brazos robustos y poderosos con dedos provistos de uñas muy fuertes; pliegue gular conspicuamente grande en machos adultos y con escamas triangulares en bordes dando apariencia de sierra. En la base de la cabeza inicia una fila de escamas anchas y alargadas que se prolonga en la parte medio dorsal sobre cuerpo y cola. A los lados de la cabeza, presenta un escudo circular alargado. Comúnmente con tubérculos de espinas alargadas a los lados del cuello. Cambian de color dependiendo la edad. Se encuentra desde México hasta Brasil y el Pantanal del Paraguay, también en islas del Caribe y de manera asilvestrada en Florida (Estados Unidos). Habita selvas tropicales y manglares, en menor grado áreas áridas y semiáridas.

Sinónimos:
Basiliscus basiliscus (Linnaeus, 1758); Basiliscus americanus Laurenti, 1768; Basiliscus barbouri Ruthven, 1914; Basiliscus guttulatus cope, 1876; Basiliscus mitratus Daudin, 1802; Lacerta basiliscus Linnaeus, 1758; Lophosaura goodridgii Gray, 1852; Ophryessa bilineata Gray, 1839.

Sinónimos:
Cnemidophorus deppei Wiegmann, 1834; Cnemidophorus decemlineatus Hallowell, 1861; Cnemidophorus lativittis Cope, 1878; Cnemidophorus alfaronis Cope, 1894; Cnemidophorus deppei oligoporus Smith, 1939; Cnemidophorus deppii infernalis, Duellman & Wellman, 1960; Cnemidophorus deppei schizophorus Smith & Brandon, 1968; Cnemidophorus deppii Günther, 1885; Aspidoscelis deppii Reeder et al., 2002
Esta lagartija es de color café con cuatro líneas amarillentas sobre el lomo. Los juveniles tienen la cola de color azul metálico.

Sinonimos:
Coluber ahaetulla Linnaeus, 1758; Coluber filiformis Linnaeus, 1758; Coluber richardi Bory De Saint Vincent, 1823; Ahaetula linnei Gray, 1831; Herpetodryas affinis Steindachner, 1870; Ahaetulla urosticta Peters, 1873; Thrasops sargii Fischer, 1881; Leptophis ultramarinus Cope, 1894; Leptophis flagellum Andersson, 1901; Leptophis rostralis Lönnberg, 1902; Leptophis argentinus Werner, 1903; Leptophis maximus Weller, 1930; Leptophis vertebralis Werner, 1909
Leptophis copei Oliver, 1942; Leptophis santamartensis Bernal-Carlo & Roze, 1994.
 O. aeneus se caracteriza por ser sumamente alargadas y delgadas, así como por la cabeza y el hocico, el cual es tres o más veces más largo que el diámetro del ojo. El ojo es de tamaño mediano con pupila redonda. Parece tener una visión aguda con una amplio campo binocular de visión. La escama rostral es casi tan alta como ancha, apenas visible desde arriba. La coloración va desde pardo claro a gris amarillento en la parte de arriba, a veces bronceado uniforme o con puntos o manchas de oscuras a negras o con bordes de escamas negros. En la parte inferior el color varía desde un color amarillento hasta blanco o rojizo, ocasionalmente con manchas oscuras. La cabeza es pardo clara con una banda negra lateral que atraviesa el ojo. Las supralabiales y el área bajo la cabeza exhiben un color amarillo o blanco, ocasionalmente pardusco o bronceado. El tamaño máximo que alcanza esta especie raramente excede 1,50 metros de longitud.
O. aeneus se caracteriza por ser sumamente alargadas y delgadas, así como por la cabeza y el hocico, el cual es tres o más veces más largo que el diámetro del ojo. El ojo es de tamaño mediano con pupila redonda. Parece tener una visión aguda con una amplio campo binocular de visión. La escama rostral es casi tan alta como ancha, apenas visible desde arriba. La coloración va desde pardo claro a gris amarillento en la parte de arriba, a veces bronceado uniforme o con puntos o manchas de oscuras a negras o con bordes de escamas negros. En la parte inferior el color varía desde un color amarillento hasta blanco o rojizo, ocasionalmente con manchas oscuras. La cabeza es pardo clara con una banda negra lateral que atraviesa el ojo. Las supralabiales y el área bajo la cabeza exhiben un color amarillo o blanco, ocasionalmente pardusco o bronceado. El tamaño máximo que alcanza esta especie raramente excede 1,50 metros de longitud.
LAS AVES

Su nido es una estructura abierta y voluminosa hecha de palillos, paja y tallos de junco, ubicado usualmente en lo alto de una palma o árbol de hojas pequeñas. Ponen 2 o 3 huevos (rara vez 4) blancos, nublados con diferentes tonos de café, y profusamente manchados con café más oscuro. Se reproducen de diciembre a marzo. En el mes de setiembre se observó un ejemplar juvenil emplumado que recibía atención de ambos padres, y también la copulación de una pareja en la rama delgada de un árbol.
Caminan sobre el suelo en busca de pequeños animales muertos o atacan a algunos tales como serpientes, ranas, roedores y polluelos. Se les observa solitarios o en grupos pequeños. Es un ave rapaz que mide entre 55 y 60 cm de largo. Presenta la parte superior de la cabeza negruzca, el resto de esta y el cuello blanco grisáceo, y el dorso y pecho con líneas anchas pardas y blanco grisáceo. En vuelo se le observa una mancha alar clara y la cola blanquecina que termina con una banda negra. La piel de la cara es desnuda, rasgo típico de las aves carroñeras.

Es conocida como garza tigre; la garganta amarilla desnuda es diagnóstica. En el adulto la coronilla es negra, los lados de la cabeza son de color pizarra, y el cuello es finamente barreteado con negro y ante (se ve oliva desde cierta distancia), con rayas catañas y blancas en en centro de la parte anterior. El abdomen es rojizo y la espalda es negruzca, con vermiculaciones anteadas. La piel de la cara es verde amarillento, con una raya café claro que atraviesa el área loreal hasta el pico. La maxila es negruzca y la inferior es amarillento opaco. La tomia es de color cuerno y las patas son verde oliva apagado.

Descripción:
El dimorfismo sexual es mínimo; ambos sexos son idénticos en el plumaje y la coloración, aunque la hembra es ligeramente más grande. Las plumas del cuerpo son en su mayoría de color marrón-negruzco. La superficie inferior de las plumas de vuelo de las alas es de color gris, creando contraste con los lineamientos alares más oscuros. La cabeza es pequeña en proporción al cuerpo y no tiene plumas; en los adultos es rojiza y en las especies juveniles es gris oscuro. Tiene un pico relativamente corto, ganchudo, de color marfil. El iris de los ojos es de color marrón-grisáceo. Las patas y los pies son de color rosado, aunque a menudo con manchas blancas. Los pies son planos, relativamente débiles y poco adaptados a agarrar; las garras tampoco están diseñadas para agarrar, ya que son relativamente romas.

Sinónimo: Ajaia ajaia Linnaeus, 1789
El pico es distintivo, en forma de espátula; es la única ave grande rosada en nuestra área. Los adultos presentan la cabeza desnuda verduzca, el cuello y cuerpo entre blanco y rosado pálido, las alas de color rosado fuerte con coberteras menores de color rojo ladrillo, el pico verduzco y las patas rojizas. Durante la época reproductiva la piel de la cara muestra un baño anaranjado y el pico, coronilla y la bolsa gular son verde azulado. En los ejemplares inmaduros el cuerpo es blanco rosáceo y la cabeza está cubierta de plumón blanco apagado. Las alas son rosado pálido, la punta de las primarias son fuscas y las patas y los dedos son negruzcos. Duran tres años para alcanzar el plumaje de adulto definitivo.

Mide 101 cm. y pesa 950 grs. Es la más grande de las garzas totalmente blancas, y de cuello más largo. Tiene el pico amarillo y las patas negras en todos los plumajes. El iris es amarillo claro. La “garza del ganado” (Bubulcus ibis) es mucho más pequeña y gruesa. Las otras garzas blancas difieren por el color de las patas o el pico. Son distintivos los aletazos lentos y los cómodos planeos de esta especie durante el vuelo.

Es mediana, parduzca, con una lista alar blanca prominente y la punta blanca de la cola redondeada El adulto es principalmente café claro, más oscuro por encima y con una mancha negra que resalta en la parte baja de la mejilla. Por debajo la parte de atrás y el forro de las alas son de color gris. Las coberteras mayores son blancas, las primarias fuscas, las timoneras centrales color café y las laterales con la base gris. La lista es negra en la mitad y la punta blanca es amplia. El iris es anaranjado y el anillo ocular desnudo es azul. El pico es negro y las patas carmín. Los machos exhiben un baño purpúreo en la cabeza y el cuello, y un parche púrpura bronceado iridiscente en el costado del cuello; ambos rasgos están reducidos o ausentes en las hembras. Los ejemplares juveniles son más claros y grises, sin ningún área de color púrpura.

Es pequeña, grisácea clara, con un escamado negro, y presenta una cola larga con bordes blancos. En el macho adulto la frente y la región inferior es rosa grisáceo claro, y avanza gradualmente a blanco crema en el abdomen. Por encima es gris parduzco, más claro en las coberteras alares mayores. Presenta un escamado negruzco leve en la cara y la parte delantera del cuello y el pecho. El iris es rojo, el pico y la cera negruzcos, y las patas son de color carne. La hembra es parecida, pero por debajo muestra muy poco o casi nada de tinte rosado, y un escamado más abundante en la cabeza y el pecho. Las plumas del manto exhiben un moteado subterminal anteado.

Es bastante grande con la frente de color rojo. El adulto es principalmente verde y más claro por debajo. La mitad terminal de las timoneras externas es verde amarillento claro. Generalmente exhiben algo de amarillo en las plumas de la cara. El iris es anaranjado. La cera y el pase del pico son de color cuerno amarillento, y pasan gradualmente hacia gris en la punta. El anillo ocular desnudo es amarillento claro y las patas son grisáceo opaco. En los especímenes juveniles el iris es parduzco y presentan menos rojo en la cara.

Es grande, sin marcas coloreadas en la cabeza; las mejores señas para distinguirla en el campo son la cera negruzca y el anillo ocular claro. Los adultos son de color verde, más claro por debajo. Presentan un tinte azul opaco en las plumas de la parte superior y posterior de la cabeza, y un escamado negro en la parte posterior del cuello. La mitad distal de la cola es verde amarillento claro. Presenta un iris anaranjado y el anillo ocular desnudo blanco amarillento. El pico es de color cuerno, y pasa gradualmente a gris oscuro en la punta. Las patas son grisáceo opaco. En los ejemplares juveniles el iris es café y el resto del cuerpo es igual al de los adultos.

Es de tamaño mediano, cola larga, con azul en las alas y un patrón facial conspicuo. Los adultos son principalmente de color verde, más amarillo y claro por debajo y con un tinte oliva en el pecho. El forro de las alas es oliva amarillenta, y las remeras azules, en su mayoría, al igual que la punta de la cola. La frente es anaranjada y la coronilla es de color azul opaco. El iris es amarillo y el anillo ocular desnudo es amarillo naranja. El pico es entre blancuzco y color cuerno claro y las patas grisáceo apagado. En los individuos juveniles el naranja de la frente es menos extenso.

(Foto cortesía de Suni Marozzi)
Mide 25 cm. y pesa 230 grs. Es una Amazona pequeña con la frente blanca y conspicua, con rojo en la cara y en las coberteras alares (los machos), pero sin rojo en las secundarias. Los adultos son principalmente verdes con un escamado negro en la cabeza, el pecho y la parte superior de la espalda. La frente y la parte delantera de la coronilla son de color blanco. La parte central de la coronilla es azul, y el área orbital color rojo, y las remeras azules, en gran parte. En el macho las coberteras de las primarias son rojas, al igual que la base del vexilo interno de las timoneras. La cera y el pico son amarillos y las patas son parduzcas.

Es muy grande, con el pico robusto ligeramente curvado hacia abajo en la punta. En los adultos el plumaje del cuerpo es blanco, las plumas de vuelo son negras, y la cabeza y el cuello son negros y desnudos, con la piel áspera. El pico y las patas son negruzcos. Los individuos inmaduros presentan la cabeza y el cuello cubiertos con plumón grisáceo. El pico es principalmente de color amarillento y el plumaje del cuerpo es blanco opaco. Adquieren plumaje de adulto al año, aunque la cabeza y el cuello no se desnudan totalmente, sino hasta el cabo de otro año.

Es un ave negra de apariencia desgarbada, las alas son relativamente cortas y redondeadas, la cola es larga y colgante y la maxila con el cúlmen alto y surcos prominentes. Adulto: completamente negros con un escamado iridiscente en la cabeza y el pecho; con glaseado azul en las alas y la cola. El pico, la piel de la cara y las patas son negras. Juveniles: parecidos, pero con el pico liso. En el Refugio Nacional de Vida Silvestre Caño Negro, se observó un individuo totalmente blanco (albino).
MAMIFEROS

(Foto cortesía de Víctor Acosta)
El dorso es negruzco, grisáceo; parte ventral amarillenta, anaranjada o crema. Pelaje largo, áspero. Cara pálida, con ojeras negras desnudas, completamente negras (en adultos), estrechas y con una línea media negruzca sobre la frente; mejillas de color crema o anaranjado amarillento. Ante el resplandor de la luz, los ojos son brillantes y rojizos. Las vibrisas (bigotes, receptores táctiles receptores táctiles) largas sobre el hocico y las mejillas son negras. Cola ligeramente más larga que la longitud de la cabeza y el cuerpo juntos, con la base peluda al igual que el cuerpo y negra cerca de la base, con un extremo largo y de color blanco, algunas veces la mitad negra y la mitad blanca o toda negra. Patas negras.

(Foto cortesía de Iván Cruz)
Tamaño mediano (peso), tiene la coronilla, el tronco, la cola y las extremidades negras. Los lados de la cabeza, cuello, pecho y hombros de color blanco. Habita en la mayoría de los bosques de las tierras bajas del país. Es de hábitos diurnos y se lo observa en grupos de 2 a 24 individuos. Se alimenta de frutas, flores, hojas, huevos, lagartijas, insectos y hasta de crías de animales más grandes como pizotes.

Es el más grande de los monos de Costa Rica (peso). Es casi totalmente de color negro con sus conspicuos testículos blancos. Se le encuentra en tierras bajas y medias de todo el país. Es diurno y activo en la mañana y al atardecer. Prefiere las copas altas de los árboles, donde se alimenta de hojas, brotes y frutos.

(Foto cortesía de Iván Cruz)
Su cuerpo está cubierto por una coraza y no posee pelo por encima. Es robusto, de cabeza cónica que termina en un hocico, largo y truncado. Posee una cola cónica que termina en punta y es casi del tamaño del cuerpo. Es de cuerpo pequeño y a pesar de sus patas cortas se mueve con rapidez; estas últimas poseen garras que le permiten excavar la tierra y crear madrigueras. Su coloración es negruzca con partes blancas y beige. En este mamífero acorazado, su armadura posee nueve bandas (de ahí su nombre científico) y es una lámina pequeña cubierta de anillos duros que cubren la parte superior de su cabeza y espalda. Carece de piel, por lo que no resiste temperaturas bajas, por ello prefiere temperaturas cálidas. Normalmente se cierra para dormir o defenderse ante un peligro, pero no es común encontrarle cerrado. Tiene dientes pero no pueden morder o masticar. Su característica más asombrosa es que posee placas dérmicas cubiertas de placas epidérmicas muy parecidas a las escamas de los reptiles. Habita en cuevas, huecos, pastizales, bosques tropicales y gran variedad de áreas secas. Aunque parece más común en áreas húmedas, nunca se le ve bajo la tierra ya que no puede respirar bajo la misma, donde cavan con sus patas muy bien dotadas. La grasa se usa con fines medicinales. Con cuatro dedos en las extremidades anteriores y cinco en las posteriores, todos con fuertes garras.

Referencia del tamaño y peso, La espalda es arqueada. Los cuartos traseros son más altos que los hombros. La cabeza y la cola están bajas. Tiene una marcha en la que a cada paso rebota contra el suelo. La parte dorsal es café parduzco salpicado. La parte ventral es café amarillento pálido. El pelaje es espeso, además tiene un pelaje inferior corto y los pelos protectores son más largos (incluyendo algunos pelos muy largos de color blanco). Las orejas tienen un borde de color blanco. La cara tiene una máscara distintiva de color negro sobre las mejillas, bordeada por cejas blancas. La cola tiene la mitad de la longitud de la cabeza y el cuerpo y tiene anillos definidos de color negro y anaranjado. La pata es larga y estrecha. Ante el reflejo de la luz, los ojos son brillantes y amarillentos.

Referencia de tamaño y peso Grande y extremadamente variable. Todos excepto la forma negra (ver más adelante) tienen la cola ligeramente bordeada de color crema o blanco. La mayoría tiene manchas conspicuas en las orejas y un pelaje áspero y parduzco sobre la espalda. En Costa Rica se encuentran cuatro variedades con respecto al color: a)- dorso amarillo pálido toscamente coloreado de color pardo con negro; manchas en las orejas y vientre de color anaranjado intenso, en ocasiones, con manchas de color blanco sobre la línea media del vientre; patas, usualmente, de color café o negruzcas b)- totalmente café oscuro o negro, en ocasiones, con manchas irregulares de color café pálido sobre la espalda o los hombros; la cola es totalmente negra o café, o con el borde de color negro con café pálido c)- línea media de la espalda es de color café oscuro o gris pálido d)- la espalda es de color café parduzco o negruzco, con una línea pálida sobre los costados; la parte baja de los costados, vientre, patas y pies son de color anaranjado intenso (algunos individuos presentan manchas blancas sobre la parte media del vientre); presenta una mancha blanca en la oreja (vertiente pacífica de Costa Rica).
Bibliografía consultada
Alvarado-Quesada, G. (2006). Aves acuáticas y humedales de Costa Rica: Estado de conservación. Departamento de Historia Natural. Museo Nacional de Costa Rica. https://www.heronconservation.org/media/JHBC/vol04/art02/resources/alvarado-quesada-2006.
Bilio, M., Coze, A.S. y. Hernández-Portocarrero, A. (1999). Mangroves, shrimps and the development of coastal areas in Central America. Fisheries Bulletin, 12 (4): 20-22
Bolaños, F., Savage, J. M.; & Chaves, G. (2011). Amphibians and Reptiles of Costa Rica. Listas Zoológicas Actualizadas UCR: http://museo.biologia.ucr.ac.cr/Listas/LZAPublicaciones.htm. Museo de Zoología UCR. San Pedro, Costa Rica. (Originally Published in 2009, Last Actualization on December 6, 2011)
Calderón, R. (2005). Hongos de Costa Rica. Editorial Una (EFUNA). Universidad Nacional. Heredia. Costa Rica
Calderón-Arguedas, O., Troyo, A., Solano, M., Avendaño, A. & Beier, J. (2009). Urban mosquito species (Diptera: Culicidae) of dengue endemic communities in the Greater Puntarenas area, Costa Rica. Revista de Biología Tropical, 57(4): 1223–1234.
Carrillo, E., Wong, G.; & Sáenz, J. C. (2002). Mamíferos de Costa Rica= Costa Rica Mammals. Santo Domingo de Heredia. Costa Rica. Editorial INBio.
Castro, M. & Vargas, R. (1996). Annotated list of species of marine crustaceans (Decapoda and Stomatopoda) from Golfo Dulce, Costa Rica. Revista de Biología Tropical, 44, Suppl. 3:87-95.
Chicas, F. (1995). Distribución, diversidad y dinámica poblacional de la ictiofauna comercial de la reserva forestal Térraba-Sierpe. (tesis no publicada) Universidad de Costa Rica. Puntarenas, Costa Rica.
Coan, E. V. & Valentich-Scott, P. (2012). Bivalve Seashels of Tropical West America. Marine Bivalve Mollusks from Baja California to Northern Peru. Santa Barbara. EE UU. Santa Barbara Museum of Natural History Monographs Number 6. Studies in Biodiversity Number 4.
Cruz, R. A. & Céspedes, R. (2014). Biodiversidad del Refugio Nacional de Vida Silvestre Playa Hermosa-Punta Mala: Estructura y composición del manglar. Experiencias en investigacion y manejo de humedales interiores y marino-costeros en Costa Rica. CEMEDE. Universidad Nacional, Costa Rica
Cruz, R. A. & Jiménez, J. (1994). Moluscos asociados a las áreas de manglar de la Costa Pacífica de América Central. Heredia, Costa Rica. Editorial Fundación UNA.
Flores, M E., Ruiz, H.; Salas, U.; Menjívar, R. & Sermeño, M. (2014). Insectos asociados al bosque de mangle en Barra Salada, Sonsonate y Bahía de Jiquilisco, Usulután, El Salvador. El Salvador. Universidad de El Salvador, Facultad de Ciencias Agronómicas, Departamento de Protección vegetal.
Garguillo, M. B., Magnuson, B., & Kimball, L. (2008). A field guide to plants of Costa Rica: China. Zona Tropical Publications.
Guiry, M.D. & Guiry, G.M. (2022). Algae Base. World-wide electronic publication, National University of Ireland, Galway. https://www.algaebase.org
Jiménez, J. & Soto, R. (1985). Patrones regionales en la estructura y composición florística de los manglares de la costa Pacífica de Costa Rica. Rev. Biol. Trop. 33: 25-37.
López, B. (2006). Ecología de manglares: biogeografía, estructura y zonación. Instituto de Investigaciones Científicas. Ministerio de ciencia y tecnología. Venezuela
Lugo, A. E. & Snedaker, S. (1974). The Ecology of Mangroves. Anal. Rev. Ecol. Syst., 5: 39-64.
Marín, R., Marquetti, M. Álvarez, Y., Gutiérrez, J. M. & González, R. (2009). Especies de mosquitos (Diptera: Culicidae) y sus sitios de cría en la Región Huetar Atlántica, Costa Rica. Revista Biomédica, 20:15-231
Mora, J. M. (2000). Los mamíferos silvestres de Costa Rica. Costa Rica. Editorial UNED
Morales, J. (2000). Orquídeas, cactus y bromelias del bosque seco de Costa Rica= Orchids, Cacti and Bromeliads of the Dry Forest. Costa Rica: Editorial InBio.
Nagelkerkena, I., Blaber, S.J.M., Bouillon, S., Green, P., Haywood, M., Kirton, L. G., Meynecke, J. O., Pawlik J., Penrose H.M., Sasekumar, A. & Somerfield, P. (2008). The habitat function of mangroves for terrestrial and marine fauna: A review. Aquatic Botany, 89: 155–185
Obando-Calderón, G.; Chaves-Campos, R.; Garrigues, M.; Ramírez-Alan, O & Zook, J. (2014). Lista Oficial de las Aves de Costa Rica – Actualización 2014. Comité de Especies Raras y Registros Ornitológicos de Costa Rica (Comité Científico), Asociación Ornitológica de Costa Rica. Zeledonia 18(2):30-50.
Pizarro, F., Piedra, L., Bravo, J., Asch, J., & Asch, C. (2004). Manual de procedimientos para el manejo de los manglares, Costa Rica.Costa Rica, EFUNA.
Rivas, M. (1995). Lista actualizada de cactos (Cactaceae) de Costa Rica. Brenesia, 43/44: 31-37.
Rodríguez-Herrera, B. & Ramírez-Fernández J. D. (1014). Actualización de la lista de especies de mamíferos vivientes de Costa Rica. Mastozoología Neotropical, 21(2):275-289
Rodríguez-Quiel, E., Morales, E. C., Gómez-Villamonte, E., Gómez-González, A., Rodríguez, D. y Tejada, O. L (2010). Algas del manglar de Remedios, Chiriquí, Panamá. Puente Biológico 3: 71-87
Rodriguez Pacheco, F. & Carrasco, J. 2021. Lista de crustáceos decápodos y estomatópodos del Perú. Ministerio del Ambiente, Lima, Peruinisterio del Ambiente. Dirección de Conservación de Ecosistemas y Especies.Minam. Lima, Perú.
Rojas, J. R., Castro, R. & Pizarro J. F. (1994). Lista agregada de peces en tres zonas de manglar del Golfo de Nicoya, Costa Rica. Brenesia, 11: 89- 86
Samper-Villarreal, J. y Silva-Benavides, A. M. (2015). Complejidad estructural de los manglares de Playa Blanca, Escondido y Rincón, Golfo Dulce, Costa Rica. Rev. Biol. Trop. 63 (Supl. 1): 199-208
SINAC. (2019). Estrategia Regional para el Manejo y Conservación de los Manglares en el Golfo de Nicoya-Costa Rica 2019-2030. https://labmeh.catie.ac.cr/wp-content/uploads/2019/02/EmanglaresVF_13022019.pdf
SINAC. 2016. Plan General de Manejo de los Ecosistemas de Humedal entre Paquera, Puntarenas y Pochote, Nicoya, Guanacaste, Costa Rica. Área de Conservación Tempisque. Costa Rica.
Valerio, C. (1979). Arañas terafósidas de Costa Rica (Araneae: Theraphosidae). Psalmopoeus reduncus, redescripción, distribución y el problema de dispersión en terafósidas. Revista de Biología Tropical, 27(2): 301-308
Vargas-Castillo, R. & Vargas-Zamora, J. A. (2020). Crustaceans (Decapoda & Stomatopoda) from Golfo Dulce (Pacific, Costa Rica) in the collection of the Museum of Zoology, University of Costa Rica.. Cuadernos de Investigación 12:
Víquez H. (2002). Organización del bosque de manglar de Punta Morales, Chomes, Puntarenas. [Tesis de Licenciatura]. Universidad Nacional, Costa Rica.
Zamora-Trejos, P., & Cortés, J. (2009). Costa Rica mangroves: The north Pacific | Los manglares de Costa Rica: El Pacífico norte. Revista de Biología Tropical, 57(3), 473-488.
