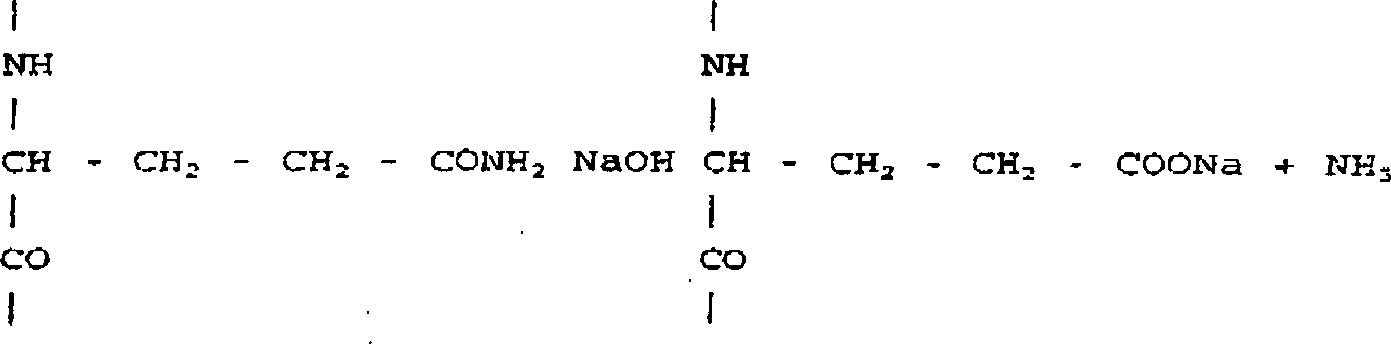DE69534713T2 - Verwendung einer kollagenmembrane zur herstellung eines implantates für gesteuerte geweberegeneration - Google Patents
Verwendung einer kollagenmembrane zur herstellung eines implantates für gesteuerte geweberegeneration Download PDFInfo
- Publication number
- DE69534713T2 DE69534713T2 DE69534713T DE69534713T DE69534713T2 DE 69534713 T2 DE69534713 T2 DE 69534713T2 DE 69534713 T DE69534713 T DE 69534713T DE 69534713 T DE69534713 T DE 69534713T DE 69534713 T2 DE69534713 T2 DE 69534713T2
- Authority
- DE
- Germany
- Prior art keywords
- membrane
- use according
- collagen
- implant
- glycosaminoglycan
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/22—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons containing macromolecular materials
- A61L15/32—Proteins, polypeptides; Degradation products or derivatives thereof, e.g. albumin, collagen, fibrin, gelatin
- A61L15/325—Collagen
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
- A01N25/34—Shaped forms, e.g. sheets, not provided for in any other sub-group of this main group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/34—Muscles; Smooth muscle cells; Heart; Cardiac stem cells; Myoblasts; Myocytes; Cardiomyocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/37—Digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/48—Reproductive organs
- A61K35/50—Placenta; Placental stem cells; Amniotic fluid; Amnion; Amniotic stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/22—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons containing macromolecular materials
- A61L15/28—Polysaccharides or their derivatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/40—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons containing ingredients of undetermined constitution or reaction products thereof, e.g. plant or animal extracts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/44—Medicaments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/22—Polypeptides or derivatives thereof, e.g. degradation products
- A61L27/24—Collagen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/3604—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix characterised by the human or animal origin of the biological material, e.g. hair, fascia, fish scales, silk, shellac, pericardium, pleura, renal tissue, amniotic membrane, parenchymal tissue, fetal tissue, muscle tissue, fat tissue, enamel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/3683—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix subjected to a specific treatment prior to implantation, e.g. decellularising, demineralising, grinding, cellular disruption/non-collagenous protein removal, anti-calcification, crosslinking, supercritical fluid extraction, enzyme treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/005—Ingredients of undetermined constitution or reaction products thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/043—Proteins; Polypeptides; Degradation products thereof
- A61L31/044—Collagen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/08—Materials for coatings
- A61L31/10—Macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L5/00—Compositions of polysaccharides or of their derivatives not provided for in groups C08L1/00 or C08L3/00
- C08L5/08—Chitin; Chondroitin sulfate; Hyaluronic acid; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/404—Biocides, antimicrobial agents, antiseptic agents
Description
- Die vorliegende Erfindung beschäftigt sich mit Wundheilung und insbesondere mit der Verwendung von Collagen enthaltenden Membranen bei der gelenkten Geweberegeneration (Guided Tissue Regeneration; GTR).
- In jeder Situation, in der Wundheilung wünschenswert ist, wie nach Operationen, insbesondere in der Mund- und Zahnchirurgie, hat sich gezeigt, dass es schwierig ist Bedingungen zu schaffen, unter denen das Einwachsen anderen Gewebes in den Bereich der Wundheilung verhindert wird. Daher ist es beispielsweise wünschenswert, dass dort, wo ein substanzieller Teil einer Zahnwurzel auf Grund von Fäule oder Krankheit entfernt wurde, eine Regeneration des gesunden Knochens stattfindet um das entfernte Knochengewebe zu ersetzen. Allerdings hat sich gezeigt, dass der bei der Entfernung des Knochens zurückbleibende Holraum schnell mit Bindegewebe gefüllt wird, und dass dieses Einwachsen von Bindegewebe eine Regeneration des Knochens effektiv unterbindet.
- Um diese Schwierigkeiten zu überwinden, wurde eine Technik entwickelt, die als „Guided Tissue Regeneration" (GTR) bekannt ist. Bei dieser Methode wird eine Membran chirurgisch um die Peripherie der Wundhöhle herum aufgebracht. Die Membran ver- oder behindert das Eidringen unerwünschter Zelltypen und erlaubt daher den gewünschten Zellen in der Wundhöhle zu wachsen und so die Wunde zu heilen.
- Zwei Membrantypen werden derzeit bei der GTR verwendet:
- 1) Synthetische, nichtresorbierbare PTFE Membranen, wie beispielsweise Goretex (trade mark); und
- 2) Synthetische resorbierbare Membranen, welche aus Glycoiden oder Lactidcopolymeren bestehen.
- Allerdings haben diese beiden Membrantypen erhebliche Nachteile. Die PTFE Membran, auch wenn sie geeignete Eigenschaften bezüglich Porosität, Stärke und Flexibilität aufweist, verbleibt als nichtresorbierbar und folglich ist eine zweite Operation notwendig um die Membran zu entfernen. Die Notwendigkeit einer weiteren Operation mag für den Patienten traumatisch sein und kann zudem zu einer Beschädigung des neuen Gewebes führen, was die Behandlungsdauer verlängert.
- Der zweite Membrantyp ist ein Gewebe aus Glycoiden und Lactidcopolymerfasern. Während diese Membran resorbierbar ist, führen die Abbauprodukte zu einer Reizung, und diese Reizung kann unvorhersehbare Folgen für den Patienten haben.
- Beide nach Stand der Technik bekannten Membranen fungieren als Filter. Sie erlauben den Durchtritt von Flüssigkeiten und stellen eine Barriere für Zellen dar. Allerdings ist die Membranoberfläche nicht „zellfreundlich", d.h. sie stabilisiert keine Blutgerinnsel und unterstützt das Zellwachstum nicht. Folglich schafft keine dieser, nach dem Stand der Technik bekannten Membranen optimale Bedingungen für Zellwachstum und Wundheilung.
- Bei Menschen und Tieren bestehen bestimmte Membranen, die wichtige Organe umgeben und verschiedene Gewebe und Zellen trennen, aus Collagen. Beispiele solcher Membranen umfassen das Bauchfell und Placentamembranen auf der Makroskala und Basalmembranen auf der Mikroskala.
- Collagenprodukte finden heute in der Medizin breite Anwendung. Eine Vielzahl von Collagenmaterialien ist verfügbar, darunter lösliches Collagen, Collagenfasern, -schwämme, -membranen und Knochenimplantate, was einen vielseitigen Einsatz dieses Materials erlaubt, beispielsweise von Collagenfasern und -tupfern zur Blutstillung, Collagenmembranen zur Bedeckung von oder zur Implantation in Wunden und Injektionen von löslichem Collagen in der plastischen Chirurgie.
- Verschiedene künstliche, Collagen enthaltende Membranen wurden im Stand der Technik beschrieben und für das Verbinden oder Abdecken von Wunden vorgeschlagen. So wird in WO-A-8808305 (The Regents of The University of California) eine Komposit-Ersatzhaut beschrieben, welche aus einer Lage menschlicher Hautzellen zusammen mit einer Lage biosynthetischer Membran, die aus Collagen oder Mucopolysachariden bestehen kann, zusammengesetzt ist. Allerdings hat der Collagen/Mucopolysaccharid-Anteil überall eine einheitliche Oberflächenbeschaffenheit und besitzt nicht die Eigenschaften der Membran, die hier für die GTR vorgeschlagen wird. Weiterhin sind solche Membranen hochgradig immunreaktiv und können nur beim Spender der Zellen eingesetzt werden. Eine weitere künstliche Collagen enthaltende Membran wird in DE-A-26 31 909 (Massachusetts Institute of Technologie) beschrieben. Diese Membran besteht aus mindestens zwei Schichten wobei die erste Schicht eine Kombination aus Kollagen und Mucopolysacchariden ist und die zweite Schicht aus einem künstlichen Polymer, wie etwa einem Polyacrylat, besteht. Allerdings ist diese Membran vollständig nichtresorbierbar, da die Collagenschicht intern so dicht quervernetzt ist, dass keine Resorption stattfinden kann.
- EP-A-0 331 786 (Chemokol Gesellschaft zur Entwicklung von Kollagenprodukten) beschreibt ein Verfahren zur Herstellung von Collagenmembranen für die Blutstillung, als Verbandsmaterial und als implantierbares Material. Diese Membranen wurden entwickelt um mit einer schnell quellenden Oberfläche und einer lockeren, schwammähnlichen Struktur ein Stoppen von Blutungen in Situationen zu ermöglichen, in denen Blut unter Druck austritt.
- DE-A-36 07 075 (American Hospital Supply Corp.) betrifft eine Methode zur Behandlung von Knochenbrüchen, bei der bioprosthetisches Gewebe rund um den Bruch auf die Knochenoberfläche aufgebracht wird um die Bildung von fibrösen Adhäsionen zwischen dem heilenden Knochen und dem umliegenden Körpergewebe zu unterbinden. Bei dem bioprosthetische Gewebe kann es sich um eine Collagenmembran handeln, die gegenüberliegende glatte und faserige Seiten besitzt. In diesen Ausführungsbeispielen kann die faserige Seite zur Knochenoberfläche hin positioniert werden, um eine bessere Verankerung zu gewährleisten; die glatte Seite stellt dann eine vorteilhaft schmierende Oberfläche zur Verfügung. Das bioprosthetische Gewebe nimmt nicht am Heilungsprozess teil, der zwischen den Bruchstellen unter der Knochenoberfläche abläuft, und wird vorzugsweise behandelt, um ihn im Wesentlichen gegen Verkalkung resistent zu machen, d.h. um das Einwachsen von Knochengewebe in das bioprostethische Gewebe zu verhindern.
- WO-A-9013302 (Brigham and Women's Hospital) offenbart resorbierbares Material zur Verwendung in der GTR, welches Collagenmembranen beinhaltet, welche eine oder mehrere biologisch aktive Substanzen, wie Arzneimittel, Hormone, Wachstumsfaktoren, Peptide oder Proteine enthalten.
- WO-A-9302718 (Coletica) offenbart langsam bioresorbierbare, Glycosaminoglycan enthaltende, quervernetzte Collagenmembranen zur Verwendung in der GTR.
- Die vorliegende Erfindung basiert auf der Erkenntnis, dass Collagenmembranen, die direkt von natürlich vorkommenden Membranen abgeleitet sind und welche so weit wie möglich ihre natürliche Collagenstruktur beibehalten, Membranen bilden, welche ideale Eigenschaften für die GTR aufweisen.
- Entsprechend stellt die Erfindung eine physiologisch verträgliche und resorbierbare Collagenmembran zur Verfügung, die durch Reinigung einer natürlichen Collagenmembran gewonnen wird, sodass sie im Wesentlichen ihre natürliche Collagenstruktur beibehält, und die gegenüberliegende faserige und glatte Seiten hat, zur Herstellung eines GTR-Implantats zur Einbringung in den menschlichen oder tierischen Körper derart, dass die besagte faserige Seite zu jenem Gebiet des besagten Körpers gerichtet ist, in welchem Gewebeheilung notwendig ist, und dass Zellwachstum darauf möglich ist, und dass die besagte, gegenüberliegende, glatte Seite Zellanlagerung darauf verhindert und als Barriere fungiert, welche den Durchtritt von Zellen durch die Membran verhindert.
- Die beiden gegenüberliegenden Seiten oder Oberflächen der Membran haben unterschiedliche Oberflächenbeschaffenheiten, welche das Zellwachstum in unterschiedlicher Weise beeinflussen. So fungiert die glatte Seite als Barriere oder als Filter, um das Einwachsen von Zellen zu behindern, und verhindert die Besiedlung der, von der Membran durch physikalische Trennung erzeugten, Höhlung durch unerwünschte Zellen. Im Gegensatz dazu verhindert die faserige Seite der Membran die Bildung von Blutgerinnseln und unterstützt das Zellwachstum durch Bereitstellung eines geeigneten Trägers für die neuen Zellen. Aus diesem Grund sollte die Membran so eingeführt werden, dass die glatte Seite nach außen weist und die faserige Seite zu den Zellen weist, an denen eine Neubildung gewünscht ist.
- Da die Membran, welche in der vorliegenden Erfindung verwendet wird, aus einer natürlichen Quelle stammt ist sie im Körper vollständig resorbierbar und bildet keine giftigen Abbauprodukte.
- Weiterhin besitzt die Membran sowohl im nassen als auch im trockenen Zustand eine Rissfestigkeit und eine Widerstandskraft gegenüber der Ausbreitung von Rissen, vergleichbar mit der von Textilien. Die Membran kann daher, falls notwendig, chirurgisch gedehnt werden. Das Membranmaterial ist stark hydrophil und zeigt im nassen Zustand eine gute Haftfähigkeit, was es erlaubt, mehrere Lagen übereinander zu stapeln. In feuchtem Zustand ist das Material sehr elastisch und erlaubt es so, ungewöhnlich geformte oder unebene Wunden angemessen zu bedecken.
- Natürliche Collagenquellen umfassen Teile von Tierhäuten mit einer vernarbten Seite, Sehnen, verschiedene Tiermembranen etc. Eine bevorzugte Membranquelle ist die natürlich vorkommende Bauchfellmembran, insbesondere von Kälbern und Ferkeln. Bauchfellmembranen von jungen Schweinen im Alter von 6–8 Wochen (Gewicht 60–80 kg) sind besonders bevorzugt.
- Das physiologisch verträgliche Membranmaterial zur Verwendung im Sinne der vorliegenden Erfindung sollte bevorzugt aus reinem, natürlichem (d.h. nicht denaturiertem), unlöslichen Collagen bestehen. Allerdings kommt Collagen im Tierkörper vergesellschaftet mit einer Anzahl von Substanzen vor, welche unvorhersagbare chemische, physikalische und/oder physiologische Eigenschaften besitzen. Folglich muss das Collagen durch einen Aufreinigungsprozess von diesen Substanzen befreit werden. Da die Natur dieser Substanzen stark variiert, ist eine enzymatische Aufreinigung nahezu unmöglich. Daher ist eine chemische Aufreinigung zu bevorzugen, wobei darauf zu achten ist, jede Veränderung der chemischen Struktur des Collagens zu vermeiden und so seine ursprünglichen, natürlichen Eigenschaften beizubehalten.
- Gemäß der bevorzugten Ausführungsform der vorliegenden Erfindung wird die benötigte physiologisch verträgliche Membran hergestellt, indem eine Säugetier-Collagenmembran, welche eine glatte und eine faserige Oberfläche besitzt, mit Alkali behandelt wird, um Fette zu verseifen und alkaliempfindliche Substanzen zu entfernen, und dann angesäuert wird um säureempfindliche Substanzen zu entfernen, gefolgt von Waschen, Trocknen, Entfetten und auf Wunsch Quervernetzung.
- Während der Aufreinigung finden die folgenden Veränderungen statt:
- – nicht-collagene Proteine werden entfernt
- – Glycosaminoglycane und Proteoglycane werden gelöst und entfernt
- – die Fette werden teilweise verseift und vollständig entfernt.
- Während dieser Behandlung können zudem die folgenden unerwünschten Veränderungen auftreten:
- – Hydrolyse der Amid-Gruppen von Asparagin und Glutamin
- – eine Verschiebung des isoelektrischen Punkts
- – Spaltung von quervernetzenden Bindungen
- – Transamidierung unter Bildung von Isopeptiden
- – Racemisierung von Aminosäuren
- – Spaltung von Peptid-Bindungen.
- Die Menge von Amidstickstoff in der Membran dient als Indikator für diese Veränderungen. Beispielsweise hat sich gezeigt, dass bei einer Halbierung der Amidstickstoff-Gehalts (d.h. von 0,7 mmol/g auf 0,35 mmol/g) mehr als 95% des Collagens weiterhin in seinem ursprünglichen Zustand vorliegt. Grundlage dieser Messung ist die Hydrolyse von Amid-Gruppen der Aminosäuren Asparagin und Glutamin:
- Der Reinheitsgrad des Collagens kann durch Aminosäureanalyse bestimmt werden. Collagen wird zu Aminosäuren hydrolysiert, was bedeutet, dass diese Analyse reines Collagen und die Entfernung von nicht-collagenen Proteinen nachweist, nicht aber die Denaturierung von Collagen.
- Zusammen mit der Aminosäureanalyse des Collagens kann auch der Gehalt an Glycosamin und Proteoglycan bestimmt werden. Diese Verunreinigungen werden hydrolysiert, und der monomere Glycosamin- und Hexosamingehalt der Membran wird chromatographisch bestimmt. Es wurde festgestellt, dass die Menge Glycosamin und Galactosamin nach der Aufreinigung ein Molekül pro 10 000 Moleküle Aminosäuren beträgt.
- Bei einer Methode der Membranherstellung werden die Rohmaterialien zunächst mit Alkali behandelt. In diesem Schritt werden NaOH-Lösungen in einem Konzentrazionsbereich von 0,2–4 Gew.-% verwendet. Die Fette werden verseift, und alle begleitenden alkaliempfindlichen Proteine, zusammen mit allen anderen alkaliempfindlichen Substanzen, wie beispielsweise Glycosaminooglycanen, Proteoglycanen etc., werden entfernt. Dieser Prozess wird durch Bestimmung des Amidstickstoffs kontrolliert. Am Ende der Alkalibehandlung sollte der Amidstickstoffgehalt zwischen 0,3 und 0,5 mmol/g betragen.
- Der zweite Schritt besteht in der Behandlung mit einer anorganischen Säure, üblicherweise HCl. Säureempfindliche Verunreinigungen werden entfernt, die Fasern schwellen stark an, und auf diese Weise wird die Faserstruktur gelockert. Das Ansäuern wird fortgesetzt, bis das Material gleichmäßig angesäuert ist.
- Dannach wird das Material gewaschen. Es hat sich als sinnvoll erwiesen, das Material zu waschen, bis der pH-Wert sich von 0,5–1,5 (während des Ansäuerns mit HCl) auf 2,5–3,5 erhöht hat. Es wird vorzugsweise mit destilliertem Wasser gewaschen.
- Das aufgequollene Material kann nun gespalten werden um eine einheitliche Dicke zu erreichen. Weitere Schritte umfassen ein Verfahren zum Abquellen, Neutralisieren und gründlichen Waschen des Materials. Hierzu wird das Material zunächst mit einer sauren (pH 2,8–3,5) Kochsalzlösung (Konzentration 5–10 Gew.-%) behandelt. Das Material ist nun vollständig abgequollen. Es wird dann mit einem Überschuss leicht alkalischen, destillierten Wassers versetzt, bis das Material einen pH-Wert von 5,8–6,5 erreicht. Das Material wird dann gründlich mit destilliertem Wasser (pH 6,0) gewaschen. Damit ist die erste Phase der Herstellung, nämlich die Reinigung, beendet. Diese wird vom Trocknen und Entfetten gefolgt.
- Das Material wird durch wiederholtes Waschen mit Aceton getrocknet. Dies verursacht ein Schrumpfen der Collagenfasern, und als Ergebnis bleibt eine offene Struktur zurück. Das Entfetten wird mit n-Hexan durchgeführt. Hierbei werden die letzen Spuren hydrophober Substanzen aus dem Material entfernt.
- Die Dicke der trockenen Membran zur Verwendung in der GTR gemäß der vorliegenden Erfindung sollte idealerweise zwischen 0,1 und 1,0 mm liegen, kann aber durch Quellen des Materials beeinflusst werden.
- Die Membran muss daher gespalten oder geschnitten werden um die erforderliche Dicke zu erhalten, vorausgesetzt, dass die zweiseitige Textur der Membran erhalten bleibt.
- Die Membran kann weiterbehandelt werden, um ihre Eigenschaften einem bestimmten Wundtyp anzupassen. So kann das Collagen der Membran quervernetzt werden, um die Membran zu stabilisieren und den Grad der Absorption durch den Körper zu verringern.
- Alle bisher bekannten Quervernetzungsreagentien, die für medizinische Produkte Verwendung finden, können für die Membranen eingesetzt werden (z.B. Formaldehyd, Glutardialdehyd, Hexamethylendiisocyanat, Dicyclohexylcarbodiimid etc.) Eine physikalische Quervernetzung kann durch Wärmebehandlung erreicht werden. In diesem Fall ist der Quervernetzungseffekt allerdings geringer, aber für die meisten Anwendungen dennoch ausreichend. Das Collagen der Membran wird durch Erhitzen auf 100–120°C (für 30 min–5 h) in geeigneter Weise physikalisch quervernetzt, wobei die Abbauzeit verlängert wird.
- Sinnvollerweise wird der Quervernetzungsgrad so gewählt, dass der Abbaugrad der Membran mit dem Wachstum neuen Gewebes und der Wundheilung korreliert. Beispielsweise benötigen Knochenzellen ungefähr 6 Wochen um eine Zahnhöhle zu füllen, und daher ist eine Membran, welche innerhalb von 8–12 Wochen absorbiert wird, geeignet, um diesen Wundtyp zu bedecken. Selbstverständlich sollte die Membran nicht stark quervernetzt sein, da die Absorptionsrate ansonsten zu gering währe und die Membran im Extremfall nicht absorbiert würde.
- Eine andere Modifikation, welche auf die Membran angewandt werden kann, besteht darin, die faserige Seite mit einem Glycosaminoglycan (GAG), wie z.B. Hyaluronsäure, Chondroitinsulfat, Dermatansulfat oder Keratansulfat zu überziehen oder zu beschichten.
- – Glycosaminoglycane, wie Hyaluronsäure, sind wichtig als Regulatormoleküle, welche die Gewebestruktur beeinflussen. Sie haben einen günstigen Einfluss auf:
- – das Eindringen von Zellen
- – den Auf- und Abbau der Fibrinmatrix
- – das Quellen der Matrix
- – Phagozytose
- – Gefäßneubildung
- Kurz nach einer Verletzung steigt der Gehalt an GAG in einer Wunde. Hyaluronsäure und dazugehörige GAGs verbinden sich zu Fibrin und bilden eine dreidimensionale Matrix (Gerinnsel), welche mit der Fibrinmatrix verwoben ist. Die ursprüngliche Fibrinmatrix wird dabei deformiert, quillt und wird poröser. Dies bedingt ein leichteres und schnelleres Eindringen von Zellen in die Matrix und Austreten von Zellen aus der Matrix.
- Hyaluronsäure und Fibrinogen reagieren spezifisch miteinander, selbst wenn sich eines der Moleküle im Festkörperzustand befindet.
- Im Entzündungszustand der Verletzung stimuliert Hyaluronsäure die Funktion der Granulozyten, verändert die Oberflächenbeschaffenheit von polymorphkernigen Leukozyten und reguliert die Phagozytoseaktivität der Zellen.
- Während der Umwandlung und des Abbaus der Hyaluronsäure-Fibrin-Matrix werden kleinere Fragmente der Hyaluronsäure produziert. Kleine Fragmente der Hyaluronsäure stimulieren die Bildung neuer Blutgefäße.
- Zudem hindern GAGs, wie Hyaluronsäure, Collagen daran, eine Immunreaktion im Wirtstier auszulösen. Um dies zu erreichen, muss das Collagen mit mindestens 1 Gew.-% GAG-Säure zur Reaktion gebracht werden.
- GAGs sind Träger von strukturell und biologisch aktiven Proteinen. Es wurde festgestellt, dass GAG-Proteinkomplexe eine wichtige Rolle bei der narbenfreien Wundheilung im Fötus spielen.
- Aus diesem Grund führt eine Imprägnierung der Collagenmembran mit GAGs, wie Hyaluronsäure, zu einer verbesserten Gewebeneubildung in einer Wunde oder Knochenverletzung.
- Vorzugsweise nimmt die GAG-Konzentration durch die Dicke der Membran zu, mit der höchsten Konzentration auf der faserigen Seite der Membran.
- Das GAG-Material kann in Form eines Gels in die Membran eingeführt werden, welches auf der faserigen Seite der Membran aufgebracht wird und dann trocknet. Diese Herangehensweise führt zu einem abnehmenden Konzentrationsgradienten in die Membran hinein, während das GAG die Membran jedoch nicht vollständig durchdringt.
- Auch wenn wir uns nicht durch theoretische Überlegungen einschränken lassen wollen, so wird doch angenommen, dass die Ketten der GAGs mit hohem Molekulargewicht neue Zellen an die Membranoberfläche dirigieren, wo sie unterstützend für das Zellwachstum wirken können.
- Es ist deshalb besonders vorteilhaft, dass die faserige Seite der Membran die Form einer Kompositmatrix aufweist, welche GAGs enthält.
- Hyaluronsäure und andere GAGs kommen natürlich im Körper vor, wobei die Haut 19 Gew.-% und das Bauchfell 13 Gew.-% Hyaluronsäure enthält. Als natürlich vorkommende Substanzen verursachen GAGs keine Probleme bezüglich Toxizität oder Resorption, sondern es wird sogar angenommen, dass als natürliche Nährstoffe für die Zellen zu fungieren.
- Hyaluronsäure und andere GAGs werden industriell hergestellt und stehen daher in kommerziellen Mengen zur Verfügung.
- Zweckmäßig enthalten Membranen zum Einsatz gemäß der vorliegenden Erfindung 0,1–30,0 Gew.-% GAG, z.B. Hyaluronsäure, vorteilhafterweise 2–10 Gew.-%.
- Falls notwendig können andere Pharmazeutika, wie Antibiotika (z.B. Tetracycline), Chemotherapeutika (z.B. Taurolidin) und andere Medikamente, ebenfalls in die Membranen eingebettet werden.
- Besonders nützlich ist die Anwendung von Membranen in der GTR entsprechend der Erfindung nach der Orofacial- oder Zahnchirurgie. Hier ist oft Knochenheilung notwendig, beispielsweise nach der teilweisen Entfernung einer Zahnwurzel oder eines Kieferteils. Der enge Mundraum macht chirurgische Eingriffe schwierig, und deshalb ist ein ungiftiges, vollresorbierbares Implantat für die GTR von großem Vorteil. Zudem ist die Natur der Membran besonders geeignet, das Wachstum von Knochenzellen zu fördern.
-
1 zeigt eine Membran gemäß der vorliegenden Erfindung im Gebrauch bei der Knochenheilung eines Zahns (1 ), welcher um die Wurzel (2 ) herum viel Knochengewebe verloren hat, was zu einer Höhlung (3 ) führt, welche normalerweise mit dem gesunden Zahn gefüllt ist. Der Zahn (2 ) ragt durch eine Schicht von Bindegewebe oder Zahnfleisch (4 ) in einen Zahnsockel (5 ). Um das Einwachsen von Bindegewebe (4 ) in die Höhlung (3 ) zu verhindern wurde eine Membranhülle (6 ) rund um den äußersten Rand der Wunde platziert. Die Membran (6 ) erstreckt sich rund um die gesamte Wundhöhle (3 ). Die Membran hat eine glatte Seite (7 ) welche von der Wundhöhle (3 ) weg weist, und eine faserige Seite (8 ) welche zur Wundhöhle (3 ) hin weist. Die faserige Seite (8 ) stellt eine Hilfsfläche für neues Zellwachstum, welches von der Zahnwurzel (2 ) ausgeht, zur Verfügung, während die glatte Fläche (7 ) der Membran (6 ) Zellen des Bindegewebes (4 ) daran hindert in die Wunde einzudringen. Die Membran (6 ) wird langsam vom Körper resorbiert, idealerweise korreliert die Membranabsorption mit der Zeit, welche für die Wundheilung benötigt wird. - Die vorliegende Erfindung kann mit Hilfe des folgenden, nicht einschränkenden Beispiels weiter erläutert werden:
- Beispiel
- Die Bauchfellmembranen junger Kälber werden mechanisch vollständig von Fleisch und Fett befreit, unter fließendem Wasser gewaschen und 12 h mit 2%iger NaOH-Lösung behandelt. Dann werden die Membranen unter fließendem Wasser gewaschen und mit 0,5%iger HCl angesäuert. Nachdem das Material über seine gesamte Dicke angesäuert wurde (ca. 3 h) wird das Material gewaschen, bis ein pH-Wert von 3,5 erreicht wird. Das Material wird dann mit 7%iger Kochsalzlösung geschrumpft, mit 1%iger NaHCO3-Lösung neutralisiert und unter fließendem Wasser gewaschen. Das Material wird danach mit Aceton dehydriert und mit n-Hexan entfettet. Der Amidstickstoffgehalt des Materials beträgt 0,47 mmol/g.
- Bestimmung des Amidstickstoffgehalts:
- (Eastoe, E; Courts, A; Practical Analytical Methods for Connective Tissue Proteins (1963)).
- Reagenzien
-
- 1. 2 N HCl (160 ml konz. HCl auf 1 L auffüllen)
- 2. 0,05 M Borax–0,1 N NaOH-Lösung (19,1 g Na2B4O7·10 H2O) + 6 g NaOH in 1 l, aufgefüllt mit kaltem, destilliertem H2O.
- 3. Indikator – angesetzt in Ethanol (0,33% Methylenblau + 0,05% Methylenrot)
- 4. 1% Borsäure mit dem Indikator 10 g Borsäure in 1 l kaltem, destilliertem H2O 8 mL Indikator. 0,7 ml 0,1 N – NaOH
- 5. 0,01 N HCl
- Method
-
- 1. 1 g trockenes Collagen wird in 50 ml 2N HCl dispergiert und 1 h zum Sieden erhitzt. Das Volumen wird bei 20°C auf 50 ml aufgefüllt.
- 2. 5 ml dieser Dispersion werden zusammen mit 20 ml von Lösung 2 in ein Mikrokjehldahl-Gefäß gefüllt; das Gemisch wird in 20 ml von Lösung 4 destilliert. Die Destillation dauert 6 min.
- 3. Die Lösung wird mit Reagenz 5 titriert.
- Berechnung
-
- ml Säureverbrauch × 20 = mmol% Amid-N
- Beispiel
-
- 1,36 ml 0,01 N HCl × 20 = 27,2 mmol% = 0,27 mmol/g Amid-N
Claims (17)
- Verwendung einer physiologisch verträglichen und resorbierbaren Collagenmembran, die durch Reinigung einer natürlichen Collagenmembran gewonnen wird, sodass diese im Wesentlichen ihre natürliche Collagenstruktur beibehält, und die gegenüberliegende faserige und glatte Seiten hat, zur Herstellung eines GTR-Implantats zur Einbringung in den menschlichen oder tierischen Körper, wobei die Membran so angewandt wird, dass die besagte faserige Seite zu jenem Gebiet des besagten Körpers gerichtet ist, in welchem Gewebeheilung notwendig ist, und dass Zellwachstum darauf möglich ist, und dass die besagte, gegenüberliegende, glatte Seite Zellanlagerung darauf verhindert und als Barriere fungiert, welche den Durchtritt von Zellen durch die Membran verhindert.
- Verwendung nach Anspruch 1, bei der die besagte Membran aus der Bauchfell-, Herzbeutel-, Plazenta- oder Basalmembran eines Säugetiers gewonnen ist.
- Verwendung nach Anspruch 2, bei der die besagte Bauchfellmembran von Kälbern oder Ferkeln stammt.
- Verwendung nach Anspruch 3, bei der die besagte Bauchfellmembran von einem 6–8 Wochen alten Schwein stammt.
- Verwendung nach einem der Ansprüche 2 bis 4, bei der die besagte Membran im Wesentlichen frei von Fett ist.
- Verwendung nach einem der Ansprüche 2 bis 5, bei der die besagte Membran im trockenen Zustand eine Dicke von 0,1–1,0 mm hat.
- Verwendung nach einem der Ansprüche 2 bis 6, bei der das Collagen quervernetzt ist, ohne nicht-resorbierbar zu werden.
- Verwendung nach einem der Ansprüche 2 bis 7, bei der die faserige Seite der Membran mit Glycosaminoglycan imprägniert ist.
- Verwendung nach Anspruch 8, bei der es sich bei dem Glycosaminoglycan um Hyaluronsäure handelt.
- Verwendung nach Anspruch 8, bei der es sich bei dem Glycosaminoglycan um Chondroitinsulfat, Dermatansulfat und/oder Keratansulfat handelt.
- Verwendung nach einem der Ansprüche 8 bis 10, bei der die imprägnierte Membran 0,1 bis 30,0 Gew.-% Glycosaminoglycan enthält.
- Verwendung nach Anspruch 11, bei der die imprägnierte Membran 2 bis 10 Gew.-% Glycosaminoglycan enthält.
- Verwendung nach einem der Ansprüche 1 bis 12, bei der das hergestellte Implantat ein oder mehrere Pharmazeutika enthält.
- Verwendung nach Anspruch 13, bei der das hergestellte Implantat Taurolidin enthält.
- Verwendung nach einem der Ansprüche 1 bis 14, bei der das hergestellte Implantat zur GTR von Knochengewebe des besagten Körpers dient.
- Verwendung nach einem der Ansprüche 1 bis 15, bei der das hergestellte Implantat der GTR in der Mundregion besagten Körpers dient.
- Verwendung nach einem der Ansprüche 1 bis 16, bei der eine Säugetiercollagenmembran mit einer glatten und einer faserigen Seite mit Alkali behandelt wird, um Fette zu verseifen und alkaliempfindliche Substanzen zu entfernen, und dann angesäuert wird, um säureempfindliche Substanzen zu entfernen, gefolgt von Waschen, Trocknen und Entfetten, sodass eine physiologisch verträgliche und resorbierbare Collagenmembran entsteht, welche weitgehend ihre natürliche Collagenstruktur beibehält.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB9400163 | 1994-01-06 | ||
| GB9400163A GB9400163D0 (en) | 1994-01-06 | 1994-01-06 | Membrane |
| PCT/GB1995/000008 WO1995018638A1 (en) | 1994-01-06 | 1995-01-04 | Membrane |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69534713D1 DE69534713D1 (de) | 2006-02-02 |
| DE69534713T2 true DE69534713T2 (de) | 2006-07-06 |
Family
ID=10748458
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69534713T Expired - Lifetime DE69534713T2 (de) | 1994-01-06 | 1995-01-04 | Verwendung einer kollagenmembrane zur herstellung eines implantates für gesteuerte geweberegeneration |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US5837278A (de) |
| EP (2) | EP1676592B1 (de) |
| JP (1) | JP3577083B2 (de) |
| AT (1) | ATE314102T1 (de) |
| CA (1) | CA2180659C (de) |
| DE (1) | DE69534713T2 (de) |
| ES (2) | ES2400947T3 (de) |
| GB (1) | GB9400163D0 (de) |
| WO (1) | WO1995018638A1 (de) |
Families Citing this family (154)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030039695A1 (en) * | 2001-08-10 | 2003-02-27 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Collagen carrier of therapeutic genetic material, and method |
| US7141072B2 (en) | 1998-10-05 | 2006-11-28 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Method for promoting regeneration of surface cartilage in a damaged joint using multi-layer covering |
| GB9721585D0 (en) * | 1997-10-10 | 1997-12-10 | Geistlich Soehne Ag | Chemical product |
| US20050186673A1 (en) * | 1995-02-22 | 2005-08-25 | Ed. Geistlich Soehne Ag Fuer Chemistrie Industrie | Collagen carrier of therapeutic genetic material, and method |
| GB9503492D0 (en) | 1995-02-22 | 1995-04-12 | Ed Geistlich S Hne A G F R Che | Chemical product |
| JPH09122227A (ja) * | 1995-10-31 | 1997-05-13 | Bio Eng Lab:Kk | 医用材料およびその製造方法 |
| JPH09122225A (ja) * | 1995-10-31 | 1997-05-13 | Bio Eng Lab:Kk | 医用材料の原料膜材およびその製造方法 |
| JP3476631B2 (ja) * | 1995-12-21 | 2003-12-10 | 株式会社アムニオテック | ヒト由来の天然コラーゲン膜からなる医用材料 |
| US6352558B1 (en) | 1996-02-22 | 2002-03-05 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Method for promoting regeneration of surface cartilage in a damage joint |
| DE19654884C2 (de) * | 1996-03-04 | 1999-07-29 | Kirsch Axel | Formkörper |
| US5940807A (en) * | 1996-05-24 | 1999-08-17 | Purcell; Daniel S. | Automated and independently accessible inventory information exchange system |
| US6569172B2 (en) | 1996-08-30 | 2003-05-27 | Verigen Transplantation Service International (Vtsi) | Method, instruments, and kit for autologous transplantation |
| US20020173806A1 (en) * | 1996-08-30 | 2002-11-21 | Verigen Transplantation Service International (Vtsi) Ag | Method for autologous transplantation |
| US5989269A (en) | 1996-08-30 | 1999-11-23 | Vts Holdings L.L.C. | Method, instruments and kit for autologous transplantation |
| US20060025786A1 (en) * | 1996-08-30 | 2006-02-02 | Verigen Transplantation Service International (Vtsi) Ag | Method for autologous transplantation |
| TW501934B (en) * | 1996-11-20 | 2002-09-11 | Tapic Int Co Ltd | Collagen material and process for making the same |
| GB9716219D0 (en) * | 1997-07-31 | 1997-10-08 | Geistlich Soehne Ag | Prevention of metastases |
| US8304390B2 (en) | 1997-07-31 | 2012-11-06 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Method of treatment for preventing or reducing tumor growth in the liver of patient |
| FR2766716B1 (fr) * | 1997-08-01 | 2000-02-18 | Cogent Sarl | Prothese composite pour la prevention des adherences post-chirurgicales et son procede d'obtention |
| FR2766717B1 (fr) * | 1997-08-01 | 2000-06-09 | Cogent Sarl | Prothese composite pour la prevention des adherences post-chirurgicales et son procede d'obtention |
| US7122615B1 (en) * | 1998-09-10 | 2006-10-17 | Rutgers, The State University Of New Jersey | Polyanhydrides with therapeutically useful degradation products |
| US6486214B1 (en) * | 1997-09-10 | 2002-11-26 | Rutgers, The State University Of New Jersey | Polyanhydride linkers for production of drug polymers and drug polymer compositions produced thereby |
| US6468519B1 (en) | 1997-09-10 | 2002-10-22 | Rutgers, The State University Of New Jersey | Polyanhydrides with biologically active degradation products |
| US8858981B2 (en) | 1997-10-10 | 2014-10-14 | Ed. Geistlich Soehne Fuer Chemistrie Industrie | Bone healing material comprising matrix carrying bone-forming cells |
| US20050186283A1 (en) * | 1997-10-10 | 2005-08-25 | Ed. Geistlich Soehne Ag Fuer Chemistrie Industrie | Collagen carrier of therapeutic genetic material, and method |
| US9034315B2 (en) | 1997-10-10 | 2015-05-19 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Cell-charged multi-layer collagen membrane |
| US20030180263A1 (en) * | 2002-02-21 | 2003-09-25 | Peter Geistlich | Resorbable extracellular matrix for reconstruction of bone |
| AU1655899A (en) * | 1997-12-10 | 1999-06-28 | Douglas Alan Schappert | Integrated guided-tissue-regeneration barrier for root-form dental implants |
| US7691829B2 (en) * | 1998-03-24 | 2010-04-06 | Petito George D | Composition and method for healing tissues |
| US20050208114A1 (en) * | 1998-03-24 | 2005-09-22 | Petito George D | Composition and method for healing tissues |
| EP1104313A2 (de) * | 1998-08-14 | 2001-06-06 | Verigen Transplantation Service International (VTSI) AG | Instrumente und werkstoffe für knorpelzellen-transplantation |
| DE60018814T2 (de) | 1999-01-21 | 2006-04-06 | Nipro Corp. | Nähbare Membran zur Adhäsionsverhinderung |
| US20020102709A1 (en) * | 1999-02-19 | 2002-08-01 | Tetsuya Ishikawa | Collagen-binding physiologically active polypeptide |
| US7892530B2 (en) | 1999-06-04 | 2011-02-22 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Treatment of tumor metastases and cancer |
| US8030301B2 (en) | 1999-06-04 | 2011-10-04 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Treatment of cancers with methylol-containing compounds and at least one electrolyte |
| US7345039B2 (en) | 1999-06-04 | 2008-03-18 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Enhancement of effectiveness of 5-fluorouracil in treatment of tumor metastases and cancer |
| US20020116063A1 (en) * | 1999-08-02 | 2002-08-22 | Bruno Giannetti | Kit for chondrocyte cell transplantation |
| US6221109B1 (en) * | 1999-09-15 | 2001-04-24 | Ed. Geistlich Söhne AG fur Chemische Industrie | Method of protecting spinal area |
| US6312474B1 (en) | 1999-09-15 | 2001-11-06 | Bio-Vascular, Inc. | Resorbable implant materials |
| EP1797884B1 (de) * | 1999-12-06 | 2013-09-11 | Geistlich Pharma AG | Taurolidin oder Taurultam zur Verwendung bei der Behandlung von Tumoren der Prostata, des Kolons, der Lungen und von wiederkehrendem Glioblastoma multiforme. |
| US20040038948A1 (en) | 1999-12-07 | 2004-02-26 | Uhrich Kathryn E. | Therapeutic compositions and methods |
| US6685928B2 (en) | 1999-12-07 | 2004-02-03 | Rutgers, The State University Of New Jersey | Therapeutic compositions and methods |
| ATE444086T1 (de) | 1999-12-07 | 2009-10-15 | Univ Rutgers | Therapeutische zusammensetzungen und verfahren zur behandlung von periodontitis mit entzündunshemmenden mitteln |
| US6623963B1 (en) | 1999-12-20 | 2003-09-23 | Verigen Ag | Cellular matrix |
| US6641571B2 (en) | 2000-01-05 | 2003-11-04 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Reduction of postoperative complications of cardiopulmonary bypass (CPB) surgery |
| US6682760B2 (en) | 2000-04-18 | 2004-01-27 | Colbar R&D Ltd. | Cross-linked collagen matrices and methods for their preparation |
| KR100520944B1 (ko) * | 2000-05-26 | 2005-10-17 | 꼴레띠까 | 인공조직 및 생체재료 제조용 콜라겐 지지체 |
| CZ301649B6 (cs) * | 2000-06-28 | 2010-05-12 | Ed. Geistlich Soehne Ag Fur Chemische Industrie Incorporated Under The Laws Of Switzerland | Trubice pro regeneraci nervu a zpusob jejich výroby |
| DK177997B1 (da) | 2000-07-19 | 2015-02-23 | Ed Geistlich Söhne Ag Für Chemische Ind | Knoglemateriale og collagenkombination til opheling af beskadigede led |
| IT1318663B1 (it) * | 2000-08-02 | 2003-08-27 | Mediolanum Farmaceutici Srl | Membrane di collagene a due facce di cui una organizzata a livellomacromolecolare. |
| CA2365376C (en) | 2000-12-21 | 2006-03-28 | Ethicon, Inc. | Use of reinforced foam implants with enhanced integrity for soft tissue repair and regeneration |
| WO2002064182A2 (en) * | 2001-02-14 | 2002-08-22 | Genzyme Corporation | Biocompatible fleece for hemostasis and tissue engineering |
| AU784394B2 (en) * | 2001-04-27 | 2006-03-23 | Geistlich Pharma Ag | Method and membrane for mucosa regeneration |
| US6444222B1 (en) * | 2001-05-08 | 2002-09-03 | Verigen Transplantation Services International Ag | Reinforced matrices |
| JP2003160506A (ja) * | 2001-08-10 | 2003-06-03 | Ed Geistlich Soehne Ag Fuer Chemische Industrie | 治療用遺伝物質のコラーゲン担体およびその方法 |
| CA2412012C (en) * | 2001-11-20 | 2011-08-02 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Resorbable extracellular matrix containing collagen i and collagen ii for reconstruction of cartilage |
| US20030187515A1 (en) | 2002-03-26 | 2003-10-02 | Hariri Robert J. | Collagen biofabric and methods of preparing and using the collagen biofabric |
| US7166133B2 (en) * | 2002-06-13 | 2007-01-23 | Kensey Nash Corporation | Devices and methods for treating defects in the tissue of a living being |
| WO2004006863A2 (en) * | 2002-07-17 | 2004-01-22 | Rutgers, The State University | Therapeutic devices for patterned cell growth |
| US20040136968A1 (en) * | 2002-09-27 | 2004-07-15 | Verigen Ag | Autologous cells on a support matrix for tissue repair |
| US20040078090A1 (en) | 2002-10-18 | 2004-04-22 | Francois Binette | Biocompatible scaffolds with tissue fragments |
| US7144588B2 (en) | 2003-01-17 | 2006-12-05 | Synovis Life Technologies, Inc. | Method of preventing surgical adhesions |
| KR101141985B1 (ko) * | 2003-02-06 | 2012-05-17 | 고지 니시다 | 각막 상피 형성용 세포 시트, 그들의 제조 방법 및 그들의이용 방법 |
| US7368124B2 (en) * | 2003-03-07 | 2008-05-06 | Depuy Mitek, Inc. | Method of preparation of bioabsorbable porous reinforced tissue implants and implants thereof |
| US8197837B2 (en) | 2003-03-07 | 2012-06-12 | Depuy Mitek, Inc. | Method of preparation of bioabsorbable porous reinforced tissue implants and implants thereof |
| US8226715B2 (en) | 2003-06-30 | 2012-07-24 | Depuy Mitek, Inc. | Scaffold for connective tissue repair |
| US10583220B2 (en) | 2003-08-11 | 2020-03-10 | DePuy Synthes Products, Inc. | Method and apparatus for resurfacing an articular surface |
| US7296998B2 (en) * | 2003-09-22 | 2007-11-20 | Bartee Chaddick M | Hydrophilic high density PTFE medical barrier |
| DE10349722A1 (de) | 2003-10-23 | 2005-06-16 | Beschorner, Katharina, Dr. | Zusammensetzung zur Arthrose-/Arthritisbehandlung, insbesondere von Gelenken |
| US11395865B2 (en) | 2004-02-09 | 2022-07-26 | DePuy Synthes Products, Inc. | Scaffolds with viable tissue |
| JP5008396B2 (ja) * | 2004-04-30 | 2012-08-22 | サンスター スイス エスエー | 生体適合膜及びその製造方法 |
| CN100372576C (zh) * | 2004-12-29 | 2008-03-05 | 东华大学 | 可促进神经再生的复合胶原神经导管及其中空湿法纺丝成形方法 |
| CN101252957A (zh) * | 2005-06-30 | 2008-08-27 | 人类起源公司 | 使用胎盘源胶原生物纤维的鼓膜修复 |
| WO2007028078A2 (en) * | 2005-09-02 | 2007-03-08 | Ed. Geistlich Soehne Ag Fuer Chemische Industrie | Method of repairing meniscal tears |
| EP2345434A3 (de) * | 2005-10-24 | 2012-04-11 | Ed. Geistlich Söhne Ag Für Chemische Industrie | Verfahren und Vorrichtung für eine Synoviazellen-geladene Kollagenmembran oder ein Gel |
| ATE397945T1 (de) * | 2006-04-05 | 2008-07-15 | Opocrin Spa | Multimikrolamellare kollagenmembranen |
| US20080026032A1 (en) * | 2006-07-27 | 2008-01-31 | Zubery Yuval | Composite implants for promoting bone regeneration and augmentation and methods for their preparation and use |
| WO2008021391A1 (en) * | 2006-08-15 | 2008-02-21 | Anthrogenesis Corporation | Umbilical cord biomaterial for medical use |
| EP2061429A2 (de) * | 2006-09-07 | 2009-05-27 | Ed. Geistlich Söhne Ag Für Chemische Industrie | Verfahren zur behandlung von knochenkrebs |
| EP2102144A4 (de) | 2006-09-13 | 2011-03-23 | Univ Rutgers | Wirkstoffe und ihre oligomere und polymere |
| US20080131522A1 (en) * | 2006-10-03 | 2008-06-05 | Qing Liu | Use of placental biomaterial for ocular surgery |
| WO2008060377A2 (en) | 2006-10-04 | 2008-05-22 | Anthrogenesis Corporation | Placental or umbilical cord tissue compositions |
| KR20210018526A (ko) | 2006-10-06 | 2021-02-17 | 안트로제네시스 코포레이션 | 천연(텔로펩티드) 태반 콜라겐 조성물 |
| PT2097116E (pt) | 2006-12-22 | 2012-12-06 | Medidom Lab | Sistema in situ para reparação de tecido intra-articular condral e ósseo |
| US9056151B2 (en) | 2007-02-12 | 2015-06-16 | Warsaw Orthopedic, Inc. | Methods for collagen processing and products using processed collagen |
| US9308068B2 (en) | 2007-12-03 | 2016-04-12 | Sofradim Production | Implant for parastomal hernia |
| ES2565185T3 (es) | 2008-04-18 | 2016-04-01 | Collplant Ltd. | Métodos de generación y de uso del procolágeno |
| US9480549B2 (en) | 2008-04-25 | 2016-11-01 | Allosource | Multi-layer tissue patches |
| US9358320B2 (en) | 2008-04-25 | 2016-06-07 | Allosource | Multi-layer tissue patches |
| WO2009156866A2 (en) | 2008-06-27 | 2009-12-30 | Sofradim Production | Biosynthetic implant for soft tissue repair |
| RU2532370C2 (ru) * | 2009-01-16 | 2014-11-10 | Гайстлих Фарма Аг | Способ и мембрана для регенерации ткани |
| FR2949688B1 (fr) | 2009-09-04 | 2012-08-24 | Sofradim Production | Tissu avec picots revetu d'une couche microporeuse bioresorbable |
| BR112012023769B1 (pt) | 2010-03-23 | 2020-11-10 | Edwards Lifesciences Corporation | método para preparar material de membrana de tecido bioprotético |
| US8460691B2 (en) | 2010-04-23 | 2013-06-11 | Warsaw Orthopedic, Inc. | Fenestrated wound repair scaffold |
| US8790699B2 (en) | 2010-04-23 | 2014-07-29 | Warsaw Orthpedic, Inc. | Foam-formed collagen strand |
| US8951598B2 (en) | 2010-05-07 | 2015-02-10 | Empire Technology Development Llc | Nanoscale collagen particles and membranes |
| US8741317B2 (en) | 2010-08-19 | 2014-06-03 | Rutgers, The State University Of New Jersey | Slow-degrading polymers comprising salicylic acid for undelayed and sustained drug delivery |
| US20120221118A1 (en) | 2011-02-25 | 2012-08-30 | Obi Biologics, Inc. | Materials for soft and hard tissue repair |
| FR2972626B1 (fr) | 2011-03-16 | 2014-04-11 | Sofradim Production | Prothese comprenant un tricot tridimensionnel et ajoure |
| CN102225219B (zh) * | 2011-06-01 | 2014-01-29 | 陕西博鸿生物科技有限公司 | 一种骨组织再生引导膜及其制备方法 |
| FR2977790B1 (fr) | 2011-07-13 | 2013-07-19 | Sofradim Production | Prothese pour hernie ombilicale |
| FR2977789B1 (fr) | 2011-07-13 | 2013-07-19 | Sofradim Production | Prothese pour hernie ombilicale |
| CA2849052C (en) | 2011-09-30 | 2019-11-05 | Sofradim Production | Reversible stiffening of light weight mesh |
| US9162011B2 (en) | 2011-12-19 | 2015-10-20 | Allosource | Flowable matrix compositions and methods |
| FR2985271B1 (fr) | 2011-12-29 | 2014-01-24 | Sofradim Production | Tricot a picots |
| FR2985170B1 (fr) | 2011-12-29 | 2014-01-24 | Sofradim Production | Prothese pour hernie inguinale |
| US10071184B2 (en) * | 2012-02-29 | 2018-09-11 | Collagen Matrix, Inc. | Collagen-coated tissue-based membranes |
| EP2674166A1 (de) * | 2012-06-15 | 2013-12-18 | Universitätsmedizin der Johannes Gutenberg-Universität Mainz | Verwendung von Erythropoietin (EPO) zur lokalen Behandlung von Kiefer-Osteonekrose im Zusammenhang mit der Krebsbehandlung |
| KR101455837B1 (ko) * | 2012-07-09 | 2014-11-03 | 주식회사 오스코텍 | 조직 재생 유도용 흡수성 차폐막의 제조방법 |
| US9644177B2 (en) * | 2012-07-12 | 2017-05-09 | Board Of Regents, The University Of Texas System | Extracellular matrix films and methods of making and using same |
| FR2994185B1 (fr) | 2012-08-02 | 2015-07-31 | Sofradim Production | Procede de preparation d’une couche poreuse a base de chitosane |
| US9144579B2 (en) | 2012-08-17 | 2015-09-29 | Rutgers, The State University Of New Jersey | Polyesters and methods of use thereof |
| FR2995788B1 (fr) | 2012-09-25 | 2014-09-26 | Sofradim Production | Patch hemostatique et procede de preparation |
| FR2995778B1 (fr) | 2012-09-25 | 2015-06-26 | Sofradim Production | Prothese de renfort de la paroi abdominale et procede de fabrication |
| FR2995779B1 (fr) | 2012-09-25 | 2015-09-25 | Sofradim Production | Prothese comprenant un treillis et un moyen de consolidation |
| WO2014049446A2 (en) | 2012-09-28 | 2014-04-03 | Sofradim Production | Packaging for a hernia repair device |
| US20140120057A1 (en) | 2012-10-25 | 2014-05-01 | Rutgers, The State University Of New Jersey | Polymers and methods thereof for wound healing |
| KR101434041B1 (ko) | 2012-11-08 | 2014-08-29 | 주식회사 제네웰 | 생체조직 유래 소재로부터 제조된 재생 유도용 멤브레인 제조방법 |
| CN103961752B (zh) * | 2013-02-02 | 2016-01-20 | 深圳兰度生物材料有限公司 | 组织再生引导膜及其制备方法 |
| AU2014248873B2 (en) | 2013-03-13 | 2017-03-23 | Allosource | Fascia fibrous compositions and methods for their use and manufacture |
| US9387250B2 (en) | 2013-03-15 | 2016-07-12 | Rutgers, The State University Of New Jersey | Therapeutic compositions for bone repair |
| WO2014150784A1 (en) | 2013-03-15 | 2014-09-25 | Allosource | Cell repopulated collagen matrix for soft tissue repair and regeneration |
| US9862672B2 (en) | 2013-05-29 | 2018-01-09 | Rutgers, The State University Of New Jersey | Antioxidant-based poly(anhydride-esters) |
| FR3006581B1 (fr) | 2013-06-07 | 2016-07-22 | Sofradim Production | Prothese a base d’un textile pour voie laparoscopique |
| FR3006578B1 (fr) | 2013-06-07 | 2015-05-29 | Sofradim Production | Prothese a base d’un textile pour voie laparoscopique |
| EP2826495A1 (de) | 2013-07-19 | 2015-01-21 | Geistlich Pharma AG | Biomimetisches Kollagen-Hydroxyapatit-Verbundmaterial |
| EP2842515A1 (de) | 2013-08-29 | 2015-03-04 | nolax AG | Membran, Operations-Set mit Membran und Verfahren zum Applizieren einer Membran |
| KR101832203B1 (ko) | 2013-12-06 | 2018-02-27 | 알로소스 | 조직의 시트를 건조하는 방법 |
| US10023521B2 (en) | 2014-06-13 | 2018-07-17 | Rutgers, The State University Of New Jersey | Process and intermediates for preparing poly(anhydride-esters) |
| EP3000489B1 (de) | 2014-09-24 | 2017-04-05 | Sofradim Production | Verfahren zur Herstellung einer Antihaft-Sperrschicht |
| EP3000433B1 (de) | 2014-09-29 | 2022-09-21 | Sofradim Production | Vorrichtung zur Einführung einer Prothese zur Hernie-Behandlung in einen Einschnitt und flexible textile Prothese |
| EP3000432B1 (de) | 2014-09-29 | 2022-05-04 | Sofradim Production | Textilbasierte Prothese für die Behandlung von Leistenbruch |
| EP3029189B1 (de) | 2014-12-05 | 2021-08-11 | Sofradim Production | Prothetisches poröses Netz, sein Herstellungsverfahren und Hernienprothese |
| EP3034103A1 (de) * | 2014-12-15 | 2016-06-22 | Geistlich Pharma AG | Kollagenschwamm |
| EP3059255B1 (de) | 2015-02-17 | 2020-05-13 | Sofradim Production | Verfahren zur Herstellung einer Matrix auf Chitosanbasis mit faseroptischem Verstärkungselement |
| JP6930918B6 (ja) | 2015-04-10 | 2021-12-15 | ラトガーズ, ザ ステイト ユニバーシティ オブ ニュー ジャージー | コウジ酸ポリマー |
| EP3085337B1 (de) | 2015-04-24 | 2022-09-14 | Sofradim Production | Prothese zur unterstützung einer bruststruktur |
| EP3297695A1 (de) * | 2015-05-20 | 2018-03-28 | Gumusderelioglu, Menemse | Barrieremembran zur behandlung von periodontitis und herstellungsverfahren dafür |
| ES2676072T3 (es) | 2015-06-19 | 2018-07-16 | Sofradim Production | Prótesis sintética que comprende un tejido de punto y una película no porosa y método para formarla |
| EP3175869A1 (de) | 2015-12-04 | 2017-06-07 | Geistlich Pharma AG | Vernetzte resorbierbare formstabile membran |
| IL243401A (en) | 2015-12-29 | 2017-12-31 | Zion Karmon Ben | Instruments and methods for lifting Schneider membrane |
| EP3195830B1 (de) | 2016-01-25 | 2020-11-18 | Sofradim Production | Prothese zur hernienreparatur |
| IL248472A0 (en) | 2016-10-13 | 2017-01-31 | Zion Karmon Ben | Devices for tissue growth |
| EP3312325B1 (de) | 2016-10-21 | 2021-09-22 | Sofradim Production | Verfahren zur herstellung eines netzes mit einem daran befestigten nahtmaterial mit widerhaken und dadurch erhaltenes netz |
| US10772986B2 (en) | 2017-01-26 | 2020-09-15 | Allosource | Fascia fibrous compositions and methods for their use and manufacture |
| EP3398554A1 (de) | 2017-05-02 | 2018-11-07 | Sofradim Production | Prothese zur leistenbruch-reparatur |
| EP3409303A1 (de) | 2017-06-02 | 2018-12-05 | Geistlich Pharma AG | Verwendung einer resorbierbaren vernetzten, formstabilen zusammensetzung zur herstellung einer membran |
| WO2019115792A1 (en) | 2017-12-14 | 2019-06-20 | Geistlich Pharma Ag | Dried implant composition and injectable aqueous implant formulation |
| EP3653171A1 (de) | 2018-11-16 | 2020-05-20 | Sofradim Production | Implantate zur weichgewebereparatur |
| US10869949B2 (en) | 2019-04-11 | 2020-12-22 | Geistlich Pharma Ag | Method for treating subjects suffering from chronic ulcers |
| US10960107B2 (en) | 2019-06-14 | 2021-03-30 | Geistlich Pharma Ag | Collagen matrix or granulate blend of bone substitute material |
| KR102618676B1 (ko) | 2019-06-14 | 2023-12-27 | 가이스틀리히 파마 아게 | 아스코르브산을 함유하는 주사가능한 수성 임플란트 제형 |
| US11357891B2 (en) * | 2019-06-14 | 2022-06-14 | Geistlich Pharma Ag | Collagen matrix or granulate blend of bone substitute material |
| EP4209232A1 (de) | 2022-01-06 | 2023-07-12 | Geistlich Pharma AG | Kollagenvorrichtung zur meniskusregeneration |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2517452C3 (de) * | 1975-04-19 | 1978-11-02 | Fa. Carl Freudenberg, 6940 Weinheim | Kollagenfolie für kosmetische Anwendung |
| US4060081A (en) * | 1975-07-15 | 1977-11-29 | Massachusetts Institute Of Technology | Multilayer membrane useful as synthetic skin |
| US4185011A (en) * | 1978-10-16 | 1980-01-22 | Firma Carl Freudenberg | Process for the production of collagen fibers |
| US4292972A (en) * | 1980-07-09 | 1981-10-06 | E. R. Squibb & Sons, Inc. | Lyophilized hydrocolloio foam |
| DE3203957A1 (de) * | 1982-02-05 | 1983-08-18 | Chemokol Gesellschaft zur Entwicklung von Kollagenprodukten, 5190 Stolberg | Verfahren zur herstellung von feinporigen kollagenschwaemmen |
| US4600533A (en) * | 1984-12-24 | 1986-07-15 | Collagen Corporation | Collagen membranes for medical use |
| US4674488A (en) * | 1985-03-04 | 1987-06-23 | American Hospital Supply Corporation | Method of treating bone fractures to reduce formation of fibrous adhesions |
| JP3050879B2 (ja) | 1987-04-28 | 2000-06-12 | ザ・リージエント・オブ・ザ・ユニバーシテイ・オブ・カリフオルニア | 複合皮膚代用品の調製方法及び装置 |
| EP0331786B1 (de) * | 1988-03-11 | 1994-08-03 | CHEMOKOL G.b.R. Ing.-Büro für Kollagenprodukte | Verfahren zur Herstellung von Kollagenmembranen für Hämostase, Wundbehandlung und Implantate |
| US5573771A (en) * | 1988-08-19 | 1996-11-12 | Osteomedical Limited | Medicinal bone mineral products |
| WO1990013302A1 (en) * | 1989-04-28 | 1990-11-15 | Brigham And Women's Hospital | Novel materials and methods for guided tissue regeneration |
| FR2679778B1 (fr) * | 1991-08-02 | 1995-07-07 | Coletica | Utilisation de collagene reticule par un agent de reticulation pour la fabrication d'une membrane suturable, biocompatible, a resorption lente, ainsi qu'une telle membrane. |
| AU663150B2 (en) * | 1991-11-26 | 1995-09-28 | Research Development Foundation | Fetal membrane tubes for nerve and vessel grafts |
-
1994
- 1994-01-06 GB GB9400163A patent/GB9400163D0/en active Pending
-
1995
- 1995-01-04 AT AT95904642T patent/ATE314102T1/de active
- 1995-01-04 ES ES05078022T patent/ES2400947T3/es not_active Expired - Lifetime
- 1995-01-04 EP EP05078022A patent/EP1676592B1/de not_active Expired - Lifetime
- 1995-01-04 DE DE69534713T patent/DE69534713T2/de not_active Expired - Lifetime
- 1995-01-04 US US08/669,448 patent/US5837278A/en not_active Expired - Lifetime
- 1995-01-04 JP JP51836195A patent/JP3577083B2/ja not_active Expired - Lifetime
- 1995-01-04 ES ES95904642T patent/ES2255707T3/es not_active Expired - Lifetime
- 1995-01-04 CA CA002180659A patent/CA2180659C/en not_active Expired - Lifetime
- 1995-01-04 WO PCT/GB1995/000008 patent/WO1995018638A1/en active IP Right Grant
- 1995-01-04 EP EP95904642A patent/EP0738161B1/de not_active Revoked
Also Published As
| Publication number | Publication date |
|---|---|
| GB9400163D0 (en) | 1994-03-02 |
| EP1676592B1 (de) | 2013-01-23 |
| ATE314102T1 (de) | 2006-01-15 |
| US5837278A (en) | 1998-11-17 |
| ES2400947T3 (es) | 2013-04-15 |
| ES2255707T3 (es) | 2006-07-01 |
| EP0738161A1 (de) | 1996-10-23 |
| JP3577083B2 (ja) | 2004-10-13 |
| CA2180659A1 (en) | 1995-07-13 |
| EP1676592A1 (de) | 2006-07-05 |
| DE69534713D1 (de) | 2006-02-02 |
| WO1995018638A1 (en) | 1995-07-13 |
| EP0738161B1 (de) | 2005-12-28 |
| JPH09507144A (ja) | 1997-07-22 |
| CA2180659C (en) | 2006-11-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69534713T2 (de) | Verwendung einer kollagenmembrane zur herstellung eines implantates für gesteuerte geweberegeneration | |
| DE69737741T2 (de) | Wundverbandmaterialien mit Kollagen und oxidierter Cellulose | |
| DE2631909C2 (de) | Synthetische Haut | |
| DE69632313T2 (de) | Desorbierbare extrazelluläre matrix für rekonstruktion eines knorpelgewebes | |
| DE602004000323T2 (de) | Zubereitungen zur Wiederherstellung und Regeneration humaner Dura Mater | |
| DE69530711T2 (de) | Verwendung von kollagenmembranen als prothese für peritoneale regeneration | |
| DE3315678C2 (de) | ||
| EP0998949B1 (de) | Flexible Wundauflage auf Fibrinbasis und Verfahren zu ihrer Herstellung | |
| DE69333947T2 (de) | Heteromorphe Schwämme mit Wirkstoffen | |
| DE69729314T2 (de) | Kollagenlaminat material und verfahren zu dessen herstellung | |
| EP0030583B1 (de) | Knochenersatzmaterial und Verfahren zur Herstellung eines Knochenersatzmaterials | |
| DE3321446C2 (de) | Verwendung von Chitosan zur Erzielung einer Hämostase, zur Inhibierung der Fibroplasie und zur Förderung der Geweberegeneration einer Wunde | |
| DE69828519T2 (de) | Membran zur gesteuerten regeneration von gewebe | |
| DE3503126A1 (de) | Arzneimittel abgebender kollagenbeschichteter synthetischer gefaessersatz | |
| DE3503127A1 (de) | Kollagenbeschichteter synthetischer gefaessersatz | |
| EP0321442B1 (de) | Biologisch resorbierbares Implantationsmaterial sowie Verfahren zur Herstellung desselben | |
| DE19841698A1 (de) | Wachstumsfaktor-enthaltende Zusammensetzung zur Heilung von Gewebeschäden | |
| EP2098255B1 (de) | Verfahren zur Herstellung von Kollagen-material | |
| Amudeswari et al. | Short‐term biocompatibility studies of hydrogel‐grafted collagen copolymers | |
| DE102008013091B4 (de) | Verfahren zur Herstellung von Kollagen-Material, Kollagen-Material | |
| DE102005054937A1 (de) | Angiogenese förderndes Substrat | |
| DD231987A1 (de) | Nichtresorbierbares flachmaterial zur wundbehandlung und verfahren zu dessen herstellung | |
| RU2138296C1 (ru) | Покрытие для ран | |
| RU2138294C1 (ru) | Покрытие для ран | |
| EP2155176A2 (de) | Angiogenese förderndes substrat |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8363 | Opposition against the patent |